题目内容
(1)目前,“低碳经济”备受关注,CO2的产生及有效开发利用成为科学家研究的重要课题.向浓CaCl2溶液中通入NH3和CO2,可以制得纳米级碳酸钙(粒子直径在1?10nm之间).判断产品中是否含有纳米级碳酸钙的简单实验方法为 .
(2)一定条件下,C(s)和H2O(g)反应,能生成CO2(g)和H2(g).将C(s)和H2O(g)分别加入甲、乙两个密闭容器中,发生反应:C(s)+2H2O(g)?CO2(g)+2H2(g),其相关数据如下表所示:
①T10C时,该反应的平衡常数K= .
②乙容器中,从开始达到化学平衡时,以v(H2O)表示的速率为 .
(3)臭氧是常见的氧化剂,广泛用于水处理系统.制取臭氧的方法有多种,其中高压放电法和电解纯水法的原理如图1所示,请回答下列问题:
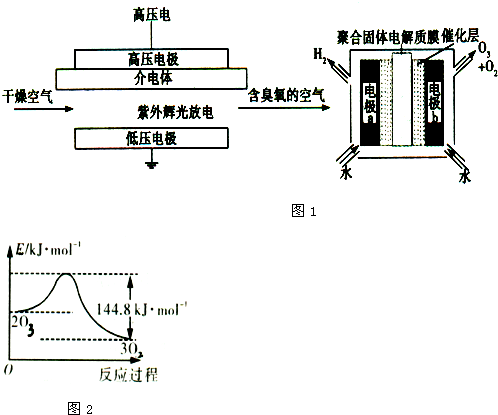
①高压放电法中,发生反应3O2(g)?2O3(g)△H=+144.8KJ.mol-1,t℃时K=3.33×10-77,下列说法正确的是 (填序号).
A.O3转化为O2的反应是放热反应
B.t0C时反应2O3(g)3O2(g)的平衡常数K≈3×1076
C.O3转化为O2的能量变化曲线如图2所示
②电解法中,电极b周围发生的电极反应有 、 ;电解时,H+由电极 经聚合固体电解质膜流向电极 (填“a”或“b”).
(2)一定条件下,C(s)和H2O(g)反应,能生成CO2(g)和H2(g).将C(s)和H2O(g)分别加入甲、乙两个密闭容器中,发生反应:C(s)+2H2O(g)?CO2(g)+2H2(g),其相关数据如下表所示:
| 容器 | 容积/L | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | |
| C(g) | H2O(g) | H2(g) | ||||
| 甲 | 2 | T1 | 2 | 4 | 3.2 | 8 |
| 乙 | 1 | T2 | 1 | 2 | 1.2 | 3 |
②乙容器中,从开始达到化学平衡时,以v(H2O)表示的速率为
(3)臭氧是常见的氧化剂,广泛用于水处理系统.制取臭氧的方法有多种,其中高压放电法和电解纯水法的原理如图1所示,请回答下列问题:

①高压放电法中,发生反应3O2(g)?2O3(g)△H=+144.8KJ.mol-1,t℃时K=3.33×10-77,下列说法正确的是
A.O3转化为O2的反应是放热反应
B.t0C时反应2O3(g)3O2(g)的平衡常数K≈3×1076
C.O3转化为O2的能量变化曲线如图2所示
②电解法中,电极b周围发生的电极反应有
分析:(1)鉴别胶体的常用方法为丁达尔效应;
(2)①利用三段式求出平衡时的浓度,再根据K的表达式计算;
②先求出参加反应的水的量,再根据速率的求算公式v=
计算;
(3)①A.根据题干中的热化学方程式判断,当方程反写时,反应热的符号相反;
B.可逆反应中正逆反应的平衡常数互为倒数关系;
C.图象错误,图中箭头表示的是逆反应的活化能,不表示反应热;
②由图可知电极b周围水失电子生成氧气和臭氧;电解时在a极生成氢气.
(2)①利用三段式求出平衡时的浓度,再根据K的表达式计算;
②先求出参加反应的水的量,再根据速率的求算公式v=
| △c |
| △t |
(3)①A.根据题干中的热化学方程式判断,当方程反写时,反应热的符号相反;
B.可逆反应中正逆反应的平衡常数互为倒数关系;
C.图象错误,图中箭头表示的是逆反应的活化能,不表示反应热;
②由图可知电极b周围水失电子生成氧气和臭氧;电解时在a极生成氢气.
解答:解:(1)向浓CaCl2溶液中通入NH3和CO2,可以制得纳米级碳酸钙,纳米级碳酸钙具有胶体的性质,而鉴别胶体的常用方法为丁达尔效应,所以要判断产品中是否含有纳米级碳酸钙的简单实验方法为丁达尔效应,故答案为:丁达尔效应;
(2)①设转化的C的物质的量为xmol
C(s)+2H2O(g)?CO2(g)+2H2(g)
起始量(mol):2 4 0 0
转化量(mol):x 2x x 2x
平衡量(mol):2-x 4-2x x 2x
已知平衡时氢气为3.2mol,即2x=3.2,所以x=1.6,则平衡时的浓度分别为:c(H2O)=0.4mol/L,c(CO2)=0.8mol/L,c(H2)=1.6mol/L,
所以K=
=
=12.8;
故答案为:12.8;
②设转化的H2O的物质的量为xmol
C(s)+2H2O(g)?CO2(g)+2H2(g)
起始量(mol):1 2 0 0
转化量(mol):
x
x
平衡量(mol):1-
2-x
x
已知平衡时氢气为1.2mol,即x=1.2 所以△c(H2O)=
=
mol/L=1.2 mol/L,则 v=
=
=0.4mol.L-1.min-1;
故答案为:0.4mol.L-1.min-1;
(3)①A.3O2(g)?2O3(g)△H=+144.8KJ.mol-1,当方程反写时,反应热的符号相反,所以2O3(g)?3O2(g)△H=-144.8KJ.mol-1,即O3转化为O2的反应是放热反应,故A正确;
B.可逆反应中正逆反应的平衡常数互为倒数关系,已知2O3(g)?3O2(g)该反应的K=3.33×10-77,所以O3转化为O2的平衡常数为
≈3×1076,故B正确;
C.图象错误,图中箭头表示的是逆反应的活化能,不表示反应热,而该反应的△H=-144.8KJ.mol-1,故C错误;
故答案为:AB;
②由图可知电极b周围水失电子生成氧气和臭氧,其反应的电极方程式为:2H2O-4e-=O2+4H+,3H2O-6e-=O3+6H+;由图可知电解时在a极生成氢气,所以H+由电极b向电极a移动;
故答案为:2H2O-4e-=O2+4H+、3H2O-6e-=O3+6H+; b、a.
(2)①设转化的C的物质的量为xmol
C(s)+2H2O(g)?CO2(g)+2H2(g)
起始量(mol):2 4 0 0
转化量(mol):x 2x x 2x
平衡量(mol):2-x 4-2x x 2x
已知平衡时氢气为3.2mol,即2x=3.2,所以x=1.6,则平衡时的浓度分别为:c(H2O)=0.4mol/L,c(CO2)=0.8mol/L,c(H2)=1.6mol/L,
所以K=
| c(CO2)?c2(H2) |
| c(H2O) |
| 0.8×1.62 |
| 0.42 |
故答案为:12.8;
②设转化的H2O的物质的量为xmol
C(s)+2H2O(g)?CO2(g)+2H2(g)
起始量(mol):1 2 0 0
转化量(mol):
| x |
| 2 |
| x |
| 2 |
平衡量(mol):1-
| x |
| 2 |
| x |
| 2 |
已知平衡时氢气为1.2mol,即x=1.2 所以△c(H2O)=
| n |
| V |
| 1.2 |
| 1 |
| △c |
| △t |
| 1.2 mol/L |
| 3min |
故答案为:0.4mol.L-1.min-1;
(3)①A.3O2(g)?2O3(g)△H=+144.8KJ.mol-1,当方程反写时,反应热的符号相反,所以2O3(g)?3O2(g)△H=-144.8KJ.mol-1,即O3转化为O2的反应是放热反应,故A正确;
B.可逆反应中正逆反应的平衡常数互为倒数关系,已知2O3(g)?3O2(g)该反应的K=3.33×10-77,所以O3转化为O2的平衡常数为
| 1 |
| K |
C.图象错误,图中箭头表示的是逆反应的活化能,不表示反应热,而该反应的△H=-144.8KJ.mol-1,故C错误;
故答案为:AB;
②由图可知电极b周围水失电子生成氧气和臭氧,其反应的电极方程式为:2H2O-4e-=O2+4H+,3H2O-6e-=O3+6H+;由图可知电解时在a极生成氢气,所以H+由电极b向电极a移动;
故答案为:2H2O-4e-=O2+4H+、3H2O-6e-=O3+6H+; b、a.
点评:本题考查了化学平衡的有关计算,化学反应中能量的变化及热化学方程式的书写,电极方程式的书写等,题目计算量较大,难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
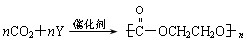 则Y的结构简式为 。
则Y的结构简式为 。
 Si(s)+4HCl(g)
Si(s)+4HCl(g)  CO2(g)+3H2(g)
CO2(g)+3H2(g)