题目内容
在25℃时,H2R及其钠盐的溶液中,H2R、HR-、R2-分别在三者中所占的物质的量分数 ( α ) 随溶液pH变化关系如图所示,下列叙述错误的是( )


| A、H2R是二元弱酸,其Ka1=1×10-2 |
| B、当溶液恰好呈中性时,c( Na +)=2c ( R2-)+c( HR-) |
| C、NaHR在溶液中水解倾向大于电离倾向 |
| D、含Na2R与NaHR各0.1 mol的混合溶液的pH=7.2 |
考点:弱电解质在水溶液中的电离平衡
专题:
分析:A、据pH=2时各离子浓度计算Ka1;
B、据电荷守恒判断;
C、NaHR溶液显酸性可知其电离程度大于其水解程度;
D、pH=7.2时,Na2R与NaHR溶液浓度相同.
B、据电荷守恒判断;
C、NaHR溶液显酸性可知其电离程度大于其水解程度;
D、pH=7.2时,Na2R与NaHR溶液浓度相同.
解答:
解:A、据图可知pH=2时,Ka1=
=
=1×10-2,故A正确;
B、据电荷守恒,c(H+)+c( Na +)=2c ( R2-)+c( HR-)+c(OH-),溶液显中性时c(H+)=c(OH-),所以c( Na +)=2c ( R2-)+c( HR-),故B正确;
C、NaHR溶液显酸性可知其电离程度大于其水解程度,故C错误;
D、Na2R与NaHR溶液浓度相同时,其pH=7.2,故D正确;
故选C.
| [H+]?[HR-] |
| [H2R] |
| 1×10-2×0.5 |
| 0.5 |
B、据电荷守恒,c(H+)+c( Na +)=2c ( R2-)+c( HR-)+c(OH-),溶液显中性时c(H+)=c(OH-),所以c( Na +)=2c ( R2-)+c( HR-),故B正确;
C、NaHR溶液显酸性可知其电离程度大于其水解程度,故C错误;
D、Na2R与NaHR溶液浓度相同时,其pH=7.2,故D正确;
故选C.
点评:本题考查了据图分析数据进行电离平衡常数的计算、电离程度与水解程度大小判断以及电荷守恒的应用,题目难度中等.

练习册系列答案
 本土教辅赢在暑假高效假期总复习云南科技出版社系列答案
本土教辅赢在暑假高效假期总复习云南科技出版社系列答案 暑假作业北京艺术与科学电子出版社系列答案
暑假作业北京艺术与科学电子出版社系列答案 第三学期赢在暑假系列答案
第三学期赢在暑假系列答案
相关题目
在中和热测定的实验时,应使用的仪器正确组合是( )
①天平 ②量筒 ③烧杯 ④酒精灯 ⑤温度计 ⑥试管 ⑦量热计⑧环形玻璃搅拌棒.
①天平 ②量筒 ③烧杯 ④酒精灯 ⑤温度计 ⑥试管 ⑦量热计⑧环形玻璃搅拌棒.
| A、①②④⑤⑧ | B、②③⑤⑦⑧ |
| C、②③④⑦⑧ | D、全部 |
下列实验装置或操作正确的是( )
A、 烧杯中通入过量的CO2,出现白色沉淀,则溶液中一定含有AlO2- 烧杯中通入过量的CO2,出现白色沉淀,则溶液中一定含有AlO2- |
B、 装置可说明浓H2SO4具有脱水性、强氧化性,SO2具有漂白性、氧化性 装置可说明浓H2SO4具有脱水性、强氧化性,SO2具有漂白性、氧化性 |
C、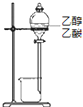 装置可以除去乙醇中的乙酸 装置可以除去乙醇中的乙酸 |
D、 装置可以比较碳酸钠、碳酸氢钠的热稳定性 装置可以比较碳酸钠、碳酸氢钠的热稳定性 |
单质或化合物A可能为Na、C、Si、N2、H2S,可以实现下列转化关系的有( )


| A、2种 | B、3种 | C、4种 | D、5种 |
 高铁酸盐在能源环保领域有广泛用途.用镍(Ni),铁做电极电解浓氢氧化钠溶液制备Na2FeO4的装置如图,说法合理的是( )
高铁酸盐在能源环保领域有广泛用途.用镍(Ni),铁做电极电解浓氢氧化钠溶液制备Na2FeO4的装置如图,说法合理的是( )| A、镍是阳极,电极反应4OH--4e-=2H2O+O2↑ |
| B、电解时电流方向:负极→镍电极→溶液→铁电极→正极 |
| C、若隔膜是阴离子交换膜,则OH-自右向左移动 |
| D、电解时阳极区pH降低,阴极区pH升高,撤去隔膜后与原溶液比较pH降低(假设电解前后体积变化忽略不计) |
将1mol两种气态烃组成的混合气体完全燃烧后得到1.5mol CO2和2mol H2O,下列说法正确的是( )
| A、一定有乙烷 |
| B、一定有甲烷 |
| C、一定没有甲烷 |
| D、不一定有甲烷 |
 已知:NH2COO-+2H2O?HCO3-+NH3?H2O.现用两份氨基甲酸铵溶液在不同温度(T1和T2)下实验,得到c(NH2COO-)随时间变化关系如图所示.以下分析正确的是( )
已知:NH2COO-+2H2O?HCO3-+NH3?H2O.现用两份氨基甲酸铵溶液在不同温度(T1和T2)下实验,得到c(NH2COO-)随时间变化关系如图所示.以下分析正确的是( )| A、无法判断T1和T2的大小关系 |
| B、T1℃时,第6min反应物转化率为6.25% |
| C、T2℃时,0~6min ν(NH2COO-)=0.3mol?L-1?min-1 |
| D、往平衡体系加水稀释,平衡右移,溶液中各种离子浓度减小 |

