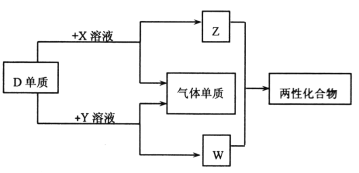
题目内容
【题目】实验室用MnO2粉末与浓盐酸共热制取氯气:MnO2+4HCl![]() MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
实验Ι验证氯气能否与水反应
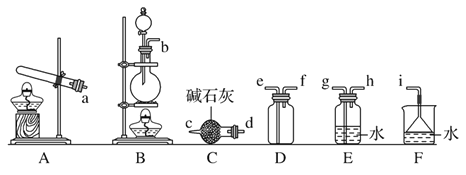
某同学设计了如下图所示的实验装置:
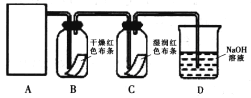
(1)从下图选择适合A处的装置__________(填序号)。
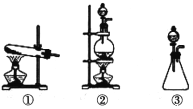
(2)装置C的实验现象 ____________________________。
(3)装置B中干燥红色布条是否褪色_________(填“是”或“否”),请说明理由____________。
(4)确定装置D的溶液中存在Cl-的试验方法是______________________________。
实验II测定反应后A中残余盐酸的浓度
步骤一:配制100mL1.00molL-1的NaOH溶液,配制过程如下:
①称量_______gNaOH固体,在烧杯中用适量蒸馏水溶解,冷却。
②将烧杯中的溶液转移至________中,并用少量蒸馏水洗涤烧杯内壁及玻璃棒2~3次,洗涤液也注入容量瓶中。
③继续加蒸馏水至离刻度线1~2cm处,改用_________滴加蒸馏水至凹槽面最低处与刻度线相切。
④盖上瓶塞,上下颠倒摇匀,将所配溶液转移至指定试剂瓶中,贴上标签。
步骤二:取2.00mL反应后A中的溶液,稀释后滴加步骤一配制所得NaOH溶液,恰好完全反应时,消耗NaOH溶液的体积为11.80mL。
(5)完成步骤一的空格。
(6)根据实验数据,计算反应后A中残余盐酸的浓度为_________molL-1。
【答案】② 湿润的红色布条褪色 是 进入B装置的氯气中混有水蒸气 取少量D溶液于试管中,滴加硝酸酸化的硝酸银溶液,产生白色沉淀,则说明有Cl 4.0 100mL容量瓶 胶头滴管 5.90
【解析】
(1)依据反应物状态和反应条件选择发生装置;
(2)依据氯气不具有漂白性,次氯酸具有漂白性;
(3)氯气中有水蒸气;
(4)结合氯离子的检验方法回答;
(5)实验II①依据m=CVM计算需要溶质的质量;
②配制溶液的应在容量瓶中配制,依据配制溶液体积选择合适规格的容量瓶;
③依据定容的正确操作解答;
(6)溶液具有均一性,依据盐酸与氢氧化钠反应关系n(HCl)=n(NaOH)计算盐酸的物质的量浓度。
(1)实验室制氯气发生的反应原理为MnO2+4HCl![]() MnCl2+Cl2↑+2H2O,反应物为固体和液体,反应条件为加热,所以应选择装置②;
MnCl2+Cl2↑+2H2O,反应物为固体和液体,反应条件为加热,所以应选择装置②;
(2)氯气溶于水生成的HClO有强氧化性,具有漂白性,则装置C的实验现象湿润的红色布条褪色;
(3)利用浓盐酸和MnO2混合加热制得的氯气中混有水蒸气,氯气溶于水生成的HClO有强氧化性,具有漂白性,则装置B中干燥红色布条褪色;
(4)确定装置D的溶液中存在Cl-的试验方法是取少量D溶液于试管中,滴加硝酸酸化的硝酸银溶液,产生白色沉淀,则说明有Cl-;
(5)①实验II①配制100mL1.00molL-1的NaOH溶液,需要氢氧化钠的质量m=1.00mol/L×0.1L×40g/mol=4.0g;
②配制100mL1.00molL-1的NaOH溶液,需要选择100mL容量瓶;
③定容时,继续加蒸馏水至离刻度线1~2cm处,改用胶头滴管滴加蒸馏水至凹槽面最低处与刻度线相切;
(6)设反应后剩余盐酸的物质的量浓度为c,则依据盐酸与氢氧化钠反应关系n(HCl)=n(NaOH)=0.01180L×1.00mol/L=0.002L×c,解得c=5.90mol/L。