题目内容
13.化学是人类进步的关键.(1)SO2、NO2是主要的空气污染物,必须经过处理后才能排放.
①消除SO2一种方法是:利用Fe3+常温下将SO2氧化为SO42-而实现SO2的处理,则反应的离子方程式为2Fe3++SO2+2H2O=2Fe2++SO42-+4H+.
②消除NO2一种方法是:在适当的催化剂存在下,用甲烷将NO2还原,反应的生成物均对环境无污染,则甲烷将NO2还原的化学方程式为CH4+2NO2=N2+CO2+2H2O.
(2)钛被称为继铁、铝之后的第三金属.金属钛的冶炼的步骤主要有:第一步:、钛铁矿(主要成分FeTiO3)在高温下与焦炭、氯气反应得到四氯化钛、三氯化铁和一种可燃性气体,写出反应的化学方程式:2FeTiO3+6C+7Cl2$\frac{\underline{\;高温\;}}{\;}$2FeCl3+2TiCl4+6CO.第二步:由TiCl4→Ti,需要在Ar气氛围中加热条件下用镁还原,反应的化学方程式为TiCl4+2Mg$\frac{\underline{\;高温\;}}{\;}$Ti+2MgCl2.
(3)高纯度单晶硅是典型的无机非金属材料.这种材料可以按下列方法制备:
SiO2 $→_{高温}^{①C}$Si(粗)$→_{300℃}^{②HCl}$SiHCl3$→_{1000℃-1100℃}^{③过量H_{2}}$Si(纯)
上述步骤①的化学方程式为SiO2+2C$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑.
(4)我国海水制盐具有悠久的历史,从海水中制得的氯化钠除食用外,还用作工业原料.写出氯碱工业中电解饱和食盐水的离子方程式:2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$H2↑+Cl2↑+2OH-.电解生成的氯气可用于生产漂白粉,反应的化学方程式:2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O.
分析 (1)①Fe3+常温下将SO2氧化为SO42-而实现SO2的处理,反应生成硫酸、亚铁离子;
②在适当的催化剂存在下,用甲烷将NO2还原生成氮气、二氧化碳和水;
(2)FeTiO3在高温下与焦炭、氯气反应得到四氯化钛、三氯化铁和一种可燃性气体,结合原子守恒为一氧化碳,TiCl4→Ti,需要在Ar气氛围中加热条件下用镁还原得到金属钛;
(3)根据SiO2与碳反应生成一氧化碳和硅;
(4)用惰性电极电解饱和氯化钠溶液时,阳极上氯离子放电、阴极上氢离子放电,同时阴极附近还生成氢氧根离子,氯气和氢氧化钙反应生成氯化钙、次氯酸钙和水.
解答 解:(1)①Fe3+常温下将SO2氧化为SO42-而实现SO2的处理,反应生成硫酸、亚铁离子,2Fe3++SO2+2H2O=2Fe2++SO42-+4H+,
故答案为:2Fe3++SO2+2H2O=2Fe2++SO42-+4H+;
②在适当的催化剂存在下,用甲烷将NO2还原生成氮气、二氧化碳和水,反应的化学方程式为:CH4+2NO2=N2+CO2+2H2O,
故答案为:CH4+2NO2=N2+CO2+2H2O;
(2)FeTiO3在高温下与焦炭、氯气反应得到四氯化钛、三氯化铁和一种可燃性气体,结合原子守恒为一氧化碳,反应的化学方程式为:2FeTiO3+6C+7Cl2$\frac{\underline{\;高温\;}}{\;}$2FeCl3+2TiCl4+6CO,TiCl4→Ti,需要在Ar气氛围中加热条件下用镁还原得到金属钛,反应的化学方程式为:TiCl4+2Mg$\frac{\underline{\;高温\;}}{\;}$Ti+2MgCl2,
故答案为:2FeTiO3+6C+7Cl2$\frac{\underline{\;高温\;}}{\;}$2FeCl3+2TiCl4+6CO,TiCl4+2Mg$\frac{\underline{\;高温\;}}{\;}$Ti+2MgCl2;
(3)工业上用焦炭在高温下置换二氧化硅中的硅来制备粗硅,方程式为:SiO2+2C$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑,
故答案为:SiO2+2C$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑;
(4)用惰性电极电解饱和氯化钠溶液时,阳极上氯离子放电、阴极上氢离子放电,同时阴极附近还生成氢氧根离子,电池反应式为2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$2OH-+Cl2↑+H2↑,氯气和氢氧化钙反应生成氯化钙、次氯酸钙和水,反应的化学方程式为:2Cl2+2 Ca(OH)2=CaCl2+Ca(ClO)2+2 H2O,
故答案为:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$2OH-+Cl2↑+H2↑,2Cl2+2 Ca(OH)2=CaCl2+Ca(ClO)2+2 H2O.
点评 本题考查了化学反应的产物分析判断,化学方程式书写,题目难度中等.

| A. | 5.6 g Fe与足量稀HNO3发生反应,转移的电子数为0.3 NA | |
| B. | 在1 L 0.1 mol/L AlCl3溶液中含有0.1 NA 个Al3+ | |
| C. | 在某密闭容器中盛有0.1 mol N2和0.3 mol H2,在一定条件下充分反应后,可得0.2NA个NH3分子 | |
| D. | 标准状况下,11.2 L四氯化碳中含有的C-Cl键的个数为2NA |
| A. | 实验剩余的药品不能放回原试剂瓶 | B. | 可燃性气体的验纯 | ||
| C. | 不能给正燃烧着的酒精灯添加酒精 | D. | 滴管不能交叉使用 |
| A. |  振荡后静置,溶液不再分层,且保持无色透明 | |
| B. |  铁片最终完全溶解,且高锰酸钾溶液变无色 | |
| C. |  微热稀HNO3片刻,溶液中有气泡产生,广口瓶内始终保持无色 | |
| D. |  当液体变成红褐色时,停止加热,让光束通过体系时可产生丁达尔效应 |
| A. | 气体摩尔体积为22.4L•mol-1 | |
| B. | 1molH2的质量是2g,它所占的体积是22.4L | |
| C. | 1mol水中含有2mol氢和1mol氧 | |
| D. | 在标准状况下,1mol任何气体所占的体积都约为22.4L |
 →CH≡C-CH═CH2
→CH≡C-CH═CH2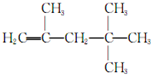 ,它是由不饱和烃乙的两个分子在一定条件下自身加成而得到的.在此反应中除生成甲外,同时还得到另一种产量更多的有机物丙,其最长的碳链仍为5个碳原子,丙是甲的同分异构体.则乙的结构简式是
,它是由不饱和烃乙的两个分子在一定条件下自身加成而得到的.在此反应中除生成甲外,同时还得到另一种产量更多的有机物丙,其最长的碳链仍为5个碳原子,丙是甲的同分异构体.则乙的结构简式是 ,丙的结构简式是
,丙的结构简式是 .
.
 .
. W、M、N、X、Y、Z是六种常见的短周期元素,其原子半径随原子序数变化如图所示.已知W的气态氢化物能使湿润的红色石蕊试纸变蓝;M和Ne原子的核外电子数相差1;N与X相邻;X的氧化物是制造光导纤维的主要原料;Y的最外层电子数是其最内层电子数的3倍;Z的非金属性在同周期主族元素中最大.
W、M、N、X、Y、Z是六种常见的短周期元素,其原子半径随原子序数变化如图所示.已知W的气态氢化物能使湿润的红色石蕊试纸变蓝;M和Ne原子的核外电子数相差1;N与X相邻;X的氧化物是制造光导纤维的主要原料;Y的最外层电子数是其最内层电子数的3倍;Z的非金属性在同周期主族元素中最大. 某化学小组设计实验元素周期表中元素的性质,请回答下列问题
某化学小组设计实验元素周期表中元素的性质,请回答下列问题