题目内容
7.有四种相同浓度的溶液:①甲酸、②碳酸、③醋酸、④石炭酸.它们的酸性由强到弱的是( )| A. | ①③④② | B. | ①③②④ | C. | ④③②① | D. | ③①④② |
分析 醋酸是乙酸,石碳酸是苯酚,根据甲酸、乙酸、碳酸、苯酚在溶液中电离出氢离子的能力分析,越容易电离氢离子,则酸性越强.
解答 解:醋酸是乙酸,石碳酸是苯酚,甲酸、乙酸、碳酸、苯酚在溶液中电离出氢离子的能力逐渐减弱,则甲酸、乙酸、碳酸、苯酚的酸性逐渐减弱,所以酸性由强到弱的顺序是:甲酸、乙酸、碳酸、苯酚;
故选B.
点评 本题考查了几种弱酸的酸性强弱比较,题目难度不大,要注意掌握常见有机酸和无机酸的酸性强弱关系.

练习册系列答案
 同步练习强化拓展系列答案
同步练习强化拓展系列答案
相关题目
17.有下列几种有机物:①CH3COOCH3②CH2=CHCH2Cl③苯乙烯④2-甲基丙烯酸甲酯⑤CH2=CCl-CHO.其中既能发生水解反应,又能发生加聚反应的是( )
| A. | ①与④ | B. | ②与⑤ | C. | ②与④ | D. | ①、③和④ |
18.下列各组离子在指定溶液中一定能大量共存的是( )
| A. | 滴加酚酞呈红色的溶液:I-,ClO-,NO3-,Na+ | |
| B. | 含有Fe3+的溶液:K+,Mg2+,SCN-,HSO3- | |
| C. | $\frac{Kw}{c({H}^{+})}$=0.1mol•L-1的溶液:Na+,K+,SiO32-,Br- | |
| D. | 加Al能生成H2的溶液:Na+,K+,CO32-,Cl- |
15.下列实验操作正确的是( )
| A. | 将氯气溶于水,须通入倒置并边缘没入水中的漏斗 | |
| B. | 粉碎结块的硝酸铵,可将药品放入研体中轻轻敲碎 | |
| C. | 洗涤做过银镜反应的试管,先用浓硝酸洗涤,再用自来水冲洗 | |
| D. | 玻璃导管与橡皮导管连接,可使玻璃导管蘸水后边旋转边插入橡皮导管 |
2.下列叙述正确的是( )
| A. | CaCO3在水中的溶解度很小,其水溶液电阻率很大,所以CaCO3是弱电解质 | |
| B. | CaCO3在水中溶解度很小,但溶于水的CaCO3全部电离,所以CaCO3是强电解质 | |
| C. | 强电解质溶液的导电能力一定强,弱电解质溶液的导电能力一定弱 | |
| D. | 液态SO2不导电,但溶于水后导电,所以SO2是电解质 |
19.下列各组离子在指定溶液中一定能大量共存的是( )
| A. | pH=1的溶液中:Mg2+,CO${\;}_{3}^{2-}$,SO${\;}_{4}^{2-}$,Na+ | |
| B. | c(Fe3+)=0.1mol•L-1的溶液中:K+,SO${\;}_{4}^{2-}$,OH- | |
| C. | 使石蕊试液变蓝色的溶液中:Mg2+,Cl-,K+ | |
| D. | 使酚酞变红的溶液中:Na+,Cl-,SO${\;}_{4}^{2-}$ |
2.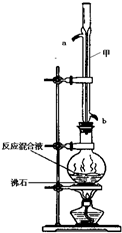 苯甲酸甲酯是一种重要的工业原料,某化学小组采用如图装置,以苯甲酸、甲醇为原料制取苯甲酸甲酯.有关物质的物理性质见下表所示:
苯甲酸甲酯是一种重要的工业原料,某化学小组采用如图装置,以苯甲酸、甲醇为原料制取苯甲酸甲酯.有关物质的物理性质见下表所示:
Ⅰ.合成苯甲酸甲酯粗产品
在圆底烧瓶中加入0.1mol苯甲酸和0.4mol甲醇,再小心加入3mL浓硫酸,混匀后,投入几粒沸石,小心加热使反应完全,得苯甲酸甲酯粗产品.
(1)甲装置的作用是:冷凝回流;冷却水从b(填“a”或“b”)口进入.
(2)化学小组在实验中用过量的反应物甲醇,其理由是该合成反应是可逆反应,甲醇比苯甲酸价廉,且甲醇沸点低,易损失,增加甲醇投料量提高产率或苯甲酸的转化率.
Ⅱ.粗产品的精制
苯甲酸甲酯粗产品中往往含有少量甲醇、硫酸、苯甲酸和水等,现拟用下列流程进行精制

(1)试剂1可以是B(填编号),作用是洗去苯甲酸甲酯中过量的酸.
A.稀硫酸 B.碳酸钠溶液 C.乙醇
(2)操作2中,收集产品时,控制的温度应在199.6℃左右.
(3)实验制得的苯甲酸甲酯精品质量为10g,则苯甲酸的转化率为73.5%(结果保留三位有效数字).
(4)本实验制得的苯甲酸甲酯的产量低于理论产量,可能的原因是C(填编号).
A.蒸馏时从100℃开始收集产品 B.甲醇用量多了 C.制备粗品时苯甲酸被蒸出.
 苯甲酸甲酯是一种重要的工业原料,某化学小组采用如图装置,以苯甲酸、甲醇为原料制取苯甲酸甲酯.有关物质的物理性质见下表所示:
苯甲酸甲酯是一种重要的工业原料,某化学小组采用如图装置,以苯甲酸、甲醇为原料制取苯甲酸甲酯.有关物质的物理性质见下表所示:| 苯甲酸 | 甲醇 | 苯甲酸甲酯 | |
| 熔点/℃ | 122.4 | -97 | -12.3 |
| 沸点/℃ | 249 | 64.3 | 199.6 |
| 密度/g.cm-3 | 1.2659 | 0.792 | 1.0888 |
| 水溶性 | 微溶 | 互溶 | 不溶 |
在圆底烧瓶中加入0.1mol苯甲酸和0.4mol甲醇,再小心加入3mL浓硫酸,混匀后,投入几粒沸石,小心加热使反应完全,得苯甲酸甲酯粗产品.
(1)甲装置的作用是:冷凝回流;冷却水从b(填“a”或“b”)口进入.
(2)化学小组在实验中用过量的反应物甲醇,其理由是该合成反应是可逆反应,甲醇比苯甲酸价廉,且甲醇沸点低,易损失,增加甲醇投料量提高产率或苯甲酸的转化率.
Ⅱ.粗产品的精制
苯甲酸甲酯粗产品中往往含有少量甲醇、硫酸、苯甲酸和水等,现拟用下列流程进行精制

(1)试剂1可以是B(填编号),作用是洗去苯甲酸甲酯中过量的酸.
A.稀硫酸 B.碳酸钠溶液 C.乙醇
(2)操作2中,收集产品时,控制的温度应在199.6℃左右.
(3)实验制得的苯甲酸甲酯精品质量为10g,则苯甲酸的转化率为73.5%(结果保留三位有效数字).
(4)本实验制得的苯甲酸甲酯的产量低于理论产量,可能的原因是C(填编号).
A.蒸馏时从100℃开始收集产品 B.甲醇用量多了 C.制备粗品时苯甲酸被蒸出.
3.已知:
现将标准状况下2.24L的CO2和2.24L的SO2分别通入两份150mL1mol/LNaOH溶液中,
关于两溶液的比较下列说法正确的是( )
| 弱酸化学式 | H2SO3 | H2CO3 |
| 电离常数(25℃) | Ka1=1.3×10-2 Ka2=6.3×10-8 | Ka1=4.2×10-7 Ka2=5.6×10-11 |
关于两溶液的比较下列说法正确的是( )
| A. | c(HCO3-)<c(CO32-) | |
| B. | 两溶液都能使酸性高锰酸钾溶液褪色 | |
| C. | c(HCO3-)>c(HSO3-) | |
| D. | c(CO32-)+c(HCO3-)=c(SO32-)+c(HSO3-) |