题目内容
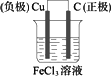
利用Cu+2FeCl3![]() 2FeCl2+CuCl2设计一个原电池.
2FeCl2+CuCl2设计一个原电池.
(1)画出装置图.
(2)写出电极的反应式.
答案:
解析:
解析:
|
答案:(1)用铜和炭棒作电极,FeCl3溶液为电解质溶液如图.
(2)电极反应式(-):Cu-2e- (+):2Fe3++2e- 解析:此化学反应为一自发进行的氧化还原反应,符合设计要求.该氧化还原反应可拆分为如下两个半反应: 氧化反应(负极反应):Cu-2e- 还原反应(正极反应):2Fe3++2e- 结合原电池构成的条件而定,负极材料为铜,正极材料可用石墨(或铂),电解质溶液为FeCl3溶液. |

练习册系列答案
相关题目
影响化学反应速率的因素很多,某课外兴趣小组用实验的方法进行探究.他们利用Cu、Fe、Mg和2mol/L硫酸设计实验方案来研究影响反应速率的因素.请完成下列实验报告:
该小组的实验目的是研究反应物本身的 对反应速率的影响;根据控制变量法,要得出正确的实验结论,还需控制的实验条件是保持 条件相同.
| 实验内容 | 实验现象 | 结论 |
| ①分别取等体积的2mol/L硫酸于试管中; ②分别投入大小、形状相同的Cu、Fe、Mg. |
反应快慢: Mg |
反应物的性质越 |

 影响化学反应速率的因素很多,某课外兴趣小组用实验的方法进行探究.
影响化学反应速率的因素很多,某课外兴趣小组用实验的方法进行探究.