题目内容
13.某同学按如图所示的装置做实验,下列说法不正确的是( )
| A. | 锌为负极,铜为正极 | B. | 电解质溶液的pH变大 | ||
| C. | 铜极上有气泡产生 | D. | 溶液中的阳离子向负极移动 |
分析 Zn-Cu、稀硫酸原电池中,Zn作负极,铜作正极,发生电池反应Zn+2H+=Zn2++H2↑,电子由负极流向正极,阳离子向正极移动,阴离子向负极移动,以此来解答.
解答 解:A.活泼金属锌作负极,铜作正极,故A正确;
B.电池总反应为Zn+2H+=Zn2++H2↑,氢离子被消耗,PH变大,故B正确;
C.氢离子在正极铜得电子产生氢气,故C正确;
D.电池工作时,阳离子移向正极,故D错误;
故选D.
点评 本题考查原电池的工作原理,为高频考点,侧重于学生的分析能力的考查,明确电极的判断、发生的电极反应、电子、离子的移动方向即可解答,题目难度不大.

练习册系列答案
相关题目
3.(实验班做) 根据热化学方程式:S(s)+O2(g)═SO2(g)△H=a KJ•mol-1(a=-297.2).分析下列说法,其中不正确的是( )
| A. | S(s)在O2(g)中燃烧的反应是放热反应 | |
| B. | 16g固体硫在空气中充分燃烧,可放出148.6 KJ的能量 | |
| C. | 1 mol SO2(g)所具有的能量低于1 mol S(s)与1 mol O2(g)所具有的能量之和 | |
| D. | S(g)+O2(g)═SO2(g)△H=b KJ•mol-1,则a<b |
4. 已知X+、Y-、Z、H2O均为10电子结构的微粒,Z可使湿润的红色石蕊试纸变蓝,它们在一定条件下可发生如图转化.下列说法正确的是( )
已知X+、Y-、Z、H2O均为10电子结构的微粒,Z可使湿润的红色石蕊试纸变蓝,它们在一定条件下可发生如图转化.下列说法正确的是( )
 已知X+、Y-、Z、H2O均为10电子结构的微粒,Z可使湿润的红色石蕊试纸变蓝,它们在一定条件下可发生如图转化.下列说法正确的是( )
已知X+、Y-、Z、H2O均为10电子结构的微粒,Z可使湿润的红色石蕊试纸变蓝,它们在一定条件下可发生如图转化.下列说法正确的是( )| A. | H2O的电子式为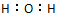 | B. | Z的沸点低于H2O的沸点 | ||
| C. | X+含有离子键 | D. | 含有Y-的溶液一定呈碱性 |
1.下列结论正确的是( )
①微粒半径:S2->Cl->F
②氢化物的稳定性:HF>HCl>H2S>H2Te
③离子的还原性:S2->Cl->Br->I-
④氧化性:Cl2>S>Se>Te
⑤酸性:H2SO4>HClO4>H2SeO4
⑥非金属性:F>Cl>S>Se
⑦单质与水反应的剧烈程度:F2<Cl2<Br2<I2.
①微粒半径:S2->Cl->F
②氢化物的稳定性:HF>HCl>H2S>H2Te
③离子的还原性:S2->Cl->Br->I-
④氧化性:Cl2>S>Se>Te
⑤酸性:H2SO4>HClO4>H2SeO4
⑥非金属性:F>Cl>S>Se
⑦单质与水反应的剧烈程度:F2<Cl2<Br2<I2.
| A. | ①②④⑥ | B. | ①③④ | C. | ①③ | D. | ⑤⑥ |
8.某元素气态氢化物的化学式为H2X,则此元素最高价氧化物对应的水化物的化学式应是( )
| A. | H2XO3 | B. | H2XO4 | C. | H3XO4 | D. | HXO4 |
5. 某有机物的结构简式图,取Na、NaOH、H2分别与等物质的量的该物质恰好反应(反应时可加热煮沸),则Na、NaOH、H2三种物质的物质的量之比为( )
某有机物的结构简式图,取Na、NaOH、H2分别与等物质的量的该物质恰好反应(反应时可加热煮沸),则Na、NaOH、H2三种物质的物质的量之比为( )
 某有机物的结构简式图,取Na、NaOH、H2分别与等物质的量的该物质恰好反应(反应时可加热煮沸),则Na、NaOH、H2三种物质的物质的量之比为( )
某有机物的结构简式图,取Na、NaOH、H2分别与等物质的量的该物质恰好反应(反应时可加热煮沸),则Na、NaOH、H2三种物质的物质的量之比为( )| A. | 3:2:5 | B. | 3:3:4 | C. | 3:2:4 | D. | 1:1:1 |
4.在给定的条件下,下列选项所示的物质间转化均能实现的是( )
| A. | SiO2$\stackrel{HCl(aq)}{→}$SiCl4$\stackrel{H_{2}}{→}$Si | |
| B. | FeS2$→_{煅烧}^{O_{2}}$SO2$\stackrel{H_{2}O}{→}$H2SO4 | |
| C. | N2$→_{高温、高压、催化剂}^{H_{2}}$NH3$\stackrel{HCl(g)}{→}$NH4Cl(s) | |
| D. | 由NaCl制漂粉精:NaCl(aq)$\stackrel{点解}{→}$Cl2$\stackrel{澄清石灰水}{→}$漂粉精 |
5.向a mL 18mol•L-1的浓硫酸中加入足量铜片,并加热,被还原的H2SO4的物质的量和起酸性作用的H2SO4的物质的量分别为( )
| A. | 大于9a×10-3mol,小于18a×10-3mol | B. | 都等于9a×10-3mol | ||
| C. | 都等于18a×10-3mol | D. | 都小于9a×10-3mol |