题目内容
(1)观察如下反应,总结规律,然后完成下列问题:
①Al(OH)3+H2O Al(OH)4- +H+
②NH3+H2O
Al(OH)4- +H+
②NH3+H2O NH4++OH-
NH4++OH-
(A)已知B(OH)3是一元弱酸,试写出其电离方程式
(B)已知N2H4是二元弱碱,试写出其二步电离方程式
。
(2)将a mol Cl2通入含 b mol FeBr2的溶液中,若0<a/b≤1/2时,反应的离子方程式为2Fe2+ +Cl2 = 2Fe3+ +2 Cl-,写出另2个可能发生的离子方程式。
①当 1/2< a/b<3/2时 。
②当a/b≥3/2时 。
(1)A、 B(OH)3+H2O B(OH)4-+H+
B(OH)4-+H+
B、N2H4+H2O
 N2H5+ +OH- N2H5+ + H2O
N2H5+ +OH- N2H5+ + H2O N2H62+ +OH-
N2H62+ +OH-
(2)①b Fe2++(2a-b)Br-+aCl2 = b Fe3++(a-b/2)Br2+2 aCl-
②2 Fe2++4Br-+3Cl2 = 2Fe3+ +2Br2+6Cl-
【解析】(1)A、B(OH)3是一元弱酸,所以根据①可知,电离方程式为B(OH)3+H2O B(OH)4-+H+。
B(OH)4-+H+。
B、N2H4是二元弱碱,则根据②可知,电离方程式为N2H4+H2O
 N2H5+ +OH-、N2H5+
+ H2O
N2H5+ +OH-、N2H5+
+ H2O N2H62+ +OH-。
N2H62+ +OH-。
(2)由于亚铁离子的还原性强于溴离子的,所以氯气首先氧化亚铁离子。氧化亚铁离子需要b/2mol,全部氧化溴化亚铁需要3b/2mol,所以当1/2< a/b<3/2时,亚停止了全部被氧化,溴离子部分被氧化,方程式为b Fe2++(2a-b)Br-+aCl2 = b Fe3++(a-b/2)Br2+2 aCl-;当a/b≥3/2时,溴化亚铁全部被氧化,方程式为2 Fe2++4Br-+3Cl2 = 2Fe3+ +2Br2+6Cl- 。

 (1)服用含碘化钾的碘药片可抗核辐射.将碘片剥去糖衣皮研粹后置于试管中制得无色水溶液,并加入几滴淀粉试液,然后向试管中逐滴加入氯水,观察到溶液由无色变为蓝色,若继续滴加氯水后蓝色溶液又褪为无色,试回答下列问题:
(1)服用含碘化钾的碘药片可抗核辐射.将碘片剥去糖衣皮研粹后置于试管中制得无色水溶液,并加入几滴淀粉试液,然后向试管中逐滴加入氯水,观察到溶液由无色变为蓝色,若继续滴加氯水后蓝色溶液又褪为无色,试回答下列问题: Al(OH)4- +H+ ②NH3+H2O
Al(OH)4- +H+ ②NH3+H2O Al(OH)4-+ H+
②NH3+H2O
Al(OH)4-+ H+
②NH3+H2O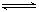 Al(OH)4- + H+
②NH3+H2O
Al(OH)4- + H+
②NH3+H2O