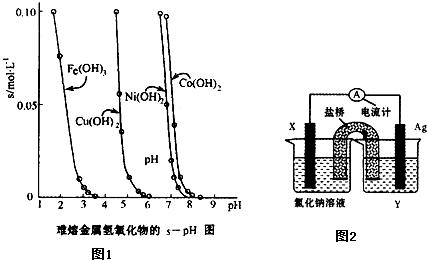
题目内容
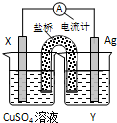 依据氧化还原反应:2Ag+(aq)+Cu(s)═Cu2+(aq)+2Ag(s)设计的原电池如图所示.请回答下列问题:
依据氧化还原反应:2Ag+(aq)+Cu(s)═Cu2+(aq)+2Ag(s)设计的原电池如图所示.请回答下列问题:(1)电极X的材料是
(2)外电路中的电子是从
(3)银电极上发生的电极反应式为
分析:含有盐桥的原电池中,电极材料和相对应电解质溶液中阳离子元素相同,原电池放电时,电子从负极沿导线流向正极,负极上失电子发生氧化反应,正极上得电子发生还原反应.
解答:解:(1)含有盐桥的原电池中,电极材料和相对应电解质溶液中阳离子元素相同,所以X为Cu,Y为AgNO3溶液,
故答案为:Cu; AgNO3溶液;
(2)该原电池中,铜易失电子而作负极,银作正极,电子从负极铜沿导线流向正极银,故答案为:Cu; Ag;
(3)银电极上银离子得电子生成银,电极反应式为:Ag++e-=Ag,
故答案为:Ag++e-=Ag.
故答案为:Cu; AgNO3溶液;
(2)该原电池中,铜易失电子而作负极,银作正极,电子从负极铜沿导线流向正极银,故答案为:Cu; Ag;
(3)银电极上银离子得电子生成银,电极反应式为:Ag++e-=Ag,
故答案为:Ag++e-=Ag.
点评:本题考查了原电池原理,明确含有盐桥的原电池中电极材料与相当应电解质溶液中阳离子的关系是解本题关键,注意电子不进入电解质溶液,电解质溶液是通过离子的定向移动形成电流,为易错点.

练习册系列答案
 智慧小复习系列答案
智慧小复习系列答案
相关题目
 依据氧化还原反应:2Ag+ (aq)+Cu(s)═Cu2+ (aq)+2Ag(s)设计的原电池如图所示.
依据氧化还原反应:2Ag+ (aq)+Cu(s)═Cu2+ (aq)+2Ag(s)设计的原电池如图所示. 依据氧化还原反应:
依据氧化还原反应: