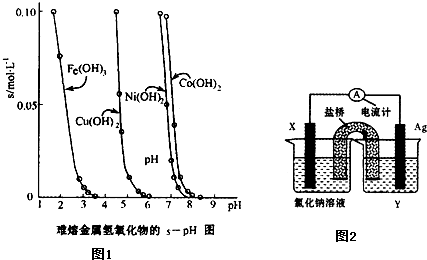
题目内容
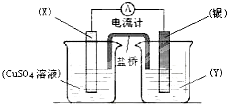 依据氧化还原反应:2Ag+ (aq)+Cu(s)═Cu2+ (aq)+2Ag(s)设计的原电池如图所示.
依据氧化还原反应:2Ag+ (aq)+Cu(s)═Cu2+ (aq)+2Ag(s)设计的原电池如图所示.请回答下列问题:
(1)电极X的材料是
铜
铜
;电解质溶液Y是AgNO3溶液
AgNO3溶液
;(2)银电极为电池的
正
正
极,发生的电极反应为Ag++e-=Ag
Ag++e-=Ag
;X电极上发生的电极反应为Cu-2e-=Cu2+
Cu-2e-=Cu2+
;(3)外电路中的电子是从
铜
铜
电极流向银
银
电极.外电路中每通过0.1mol电子,银电极的质量理论上增加10.8
10.8
g.(4)原电池工作时,盐桥(装有琼脂-KCl的U型管)里的Cl-移向
铜
铜
电极.分析:根据反应“2Ag+(aq)+Cu(s)═Cu2+(aq)+2Ag(s)”分析,在反应中,Cu被氧化,失电子,应为原电池的负极,
电极反应为Cu-2e-=Cu2+,则正极为活泼性较Cu弱的Ag,Ag+在正极上得电子被还原,电极反应为Ag++e=Ag,
电解质溶液为AgNO3 ,原电池中,电子从负极经外电路流向正极,盐桥中阴离子向负极移动,阴离子向正极移动.
电极反应为Cu-2e-=Cu2+,则正极为活泼性较Cu弱的Ag,Ag+在正极上得电子被还原,电极反应为Ag++e=Ag,
电解质溶液为AgNO3 ,原电池中,电子从负极经外电路流向正极,盐桥中阴离子向负极移动,阴离子向正极移动.
解答:解:(1)由反应“2Ag+(aq)+Cu(s)═Cu2+(aq)+2Ag(s)”可知,在反应中,Cu被氧化,失电子,应为原电池的负极,Ag+在正极上得电子被还原,电解质溶液为AgNO3 ,
故答案为:Cu;AgNO3;
(2)正极为活泼性较Cu弱的Ag,Ag+在正极上得电子被还原,电极反应为Ag++e=Ag,负极上铜失电子发生氧化反应,电极反应式为:Cu-2e-=Cu2+,
故答案为:正;Ag++e-=Ag;Cu-2e-=Cu2+;
(3)原电池中,电子从负极经外电路流向正极,本题中由Cu极经外电路流向Ag极,
设银电极质量增加为x,
Ag++e-=Ag 转移电子
108g 1mol
x 0.1mol
x=
=10.8g,
故答案为:X(或Cu);Ag;10.8g;
(5)原电池放电时,盐桥中阳离子向正极银电极移动,阴离子向负极铜电极移动,故答案为:铜.
故答案为:Cu;AgNO3;
(2)正极为活泼性较Cu弱的Ag,Ag+在正极上得电子被还原,电极反应为Ag++e=Ag,负极上铜失电子发生氧化反应,电极反应式为:Cu-2e-=Cu2+,
故答案为:正;Ag++e-=Ag;Cu-2e-=Cu2+;
(3)原电池中,电子从负极经外电路流向正极,本题中由Cu极经外电路流向Ag极,
设银电极质量增加为x,
Ag++e-=Ag 转移电子
108g 1mol
x 0.1mol
x=
| 108g×0.1mol |
| 1mol |
故答案为:X(或Cu);Ag;10.8g;
(5)原电池放电时,盐桥中阳离子向正极银电极移动,阴离子向负极铜电极移动,故答案为:铜.
点评:本题考查原电池的设计及工作原理,注意电极反应式的书写方法,牢固掌握原电池中电极的判断,电极反应式的书写的方法等问题.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
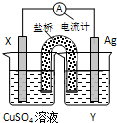 依据氧化还原反应:2Ag+(aq)+Cu(s)═Cu2+(aq)+2Ag(s)设计的原电池如图所示.请回答下列问题:
依据氧化还原反应:2Ag+(aq)+Cu(s)═Cu2+(aq)+2Ag(s)设计的原电池如图所示.请回答下列问题: 依据氧化还原反应:
依据氧化还原反应: