题目内容
金属单质及其化合物与工农业生产、日常生活有密切的联系.请回答下列问题:
(1)一定温度下,氧化铁可以与一氧化碳发生如下反应:
Fe2O3(s)+3CO(g)?2Fe(s)+3CO2(g),△H=QkJ?mol-1
①该反应的平衡常数表达式K= ;
②该温度时,在2L盛有Fe2O3粉末的密闭容器中通入CO气体,5min后,生成了单质铁11.2g,则这段时间内CO的反应速率为 ;
③达平衡后,若温度升高
的值增大,则Q 0(填“>”、“=”、“<”).
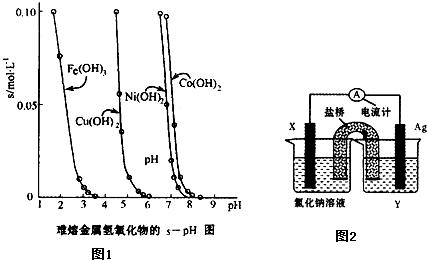
(2)工业常根据金属氢氧化物在酸中溶解度不同,通过控制溶液的pH,达到分离金属离子的目的.如图1是难溶金属的氢氧化物在不同pH下的溶解情况(s/mol?L-1).若要除去CuCl2溶液的少量Fe3+,应控制溶液的pH为 (填序号).
A.小于1 B.4左右 C.大于6 D.大于9
(3)某工业废水中含有Cu2+、Pb2+、Hg2+,若向工业废水中加入过量的FeS,当FeS、CuS、PbS和HgS共存时,溶液中c(Fe2+):c(Pb2+):c(Hg2+)= : : .已知:Ksp(FeS)=6.3×10-18mol2?L-2,Ksp(PbS)=3.4×10-28mol2?L-2Ksp(CuS)=1.3×10-36mol2?L-2,Ksp(HgS)=6.4×10-53mol2?L-2
(4)依据氧化还原反应:Cu2+(aq)+Fe(s)═Fe2+(aq)+Cu(s)设计成如图2所示的原电池,则关于该电池装置的说法中不正确的是 (填序号).
A.电极X的材料是Fe
B.电解质溶液Y是AgNO3溶液
C.原电池工作时,盐桥中的阴离子不断移向左池的氯化钠溶液中
D.原电池工作时,x电极反应为:O2+2H2O+4e-→4OH-.

(1)一定温度下,氧化铁可以与一氧化碳发生如下反应:
Fe2O3(s)+3CO(g)?2Fe(s)+3CO2(g),△H=QkJ?mol-1
①该反应的平衡常数表达式K=
②该温度时,在2L盛有Fe2O3粉末的密闭容器中通入CO气体,5min后,生成了单质铁11.2g,则这段时间内CO的反应速率为
③达平衡后,若温度升高
| [CO] | [CO2] |
(2)工业常根据金属氢氧化物在酸中溶解度不同,通过控制溶液的pH,达到分离金属离子的目的.如图1是难溶金属的氢氧化物在不同pH下的溶解情况(s/mol?L-1).若要除去CuCl2溶液的少量Fe3+,应控制溶液的pH为
A.小于1 B.4左右 C.大于6 D.大于9
(3)某工业废水中含有Cu2+、Pb2+、Hg2+,若向工业废水中加入过量的FeS,当FeS、CuS、PbS和HgS共存时,溶液中c(Fe2+):c(Pb2+):c(Hg2+)=
(4)依据氧化还原反应:Cu2+(aq)+Fe(s)═Fe2+(aq)+Cu(s)设计成如图2所示的原电池,则关于该电池装置的说法中不正确的是
A.电极X的材料是Fe
B.电解质溶液Y是AgNO3溶液
C.原电池工作时,盐桥中的阴离子不断移向左池的氯化钠溶液中
D.原电池工作时,x电极反应为:O2+2H2O+4e-→4OH-.
分析:(1)①Fe2O3和Fe是固体,不能写在表达式中,故K=
;
②n(Fe)=
,根据方程式可知n(CO)=
n(Fe),故可求得v(CO)
③温度升高
的值增大,平衡逆移,故正方向为放热反应;
(2)由图1可知PH在4左右时,Fe3+,完全沉淀,而Cu2+还没开始沉淀;
(3)由Ksp(HgS)=6.4×10-53mol2?L-2求出c(S2-),再分别利用各自的Ksp求出其阳离子浓度.
(4)A.根据图2可知电极X的材料是Fe;
B.电解质溶液Y是AgNO3溶液;
C.原电池工作时,盐桥中的阴离子不断移向负极移动;
D.原电池工作时,x为负极.
| [CO2]3 |
| [CO]3 |
②n(Fe)=
| m |
| M |
| 3 |
| 2 |
③温度升高
| [CO] |
| [CO2] |
(2)由图1可知PH在4左右时,Fe3+,完全沉淀,而Cu2+还没开始沉淀;
(3)由Ksp(HgS)=6.4×10-53mol2?L-2求出c(S2-),再分别利用各自的Ksp求出其阳离子浓度.
(4)A.根据图2可知电极X的材料是Fe;
B.电解质溶液Y是AgNO3溶液;
C.原电池工作时,盐桥中的阴离子不断移向负极移动;
D.原电池工作时,x为负极.
解答:解:(1)①Fe2O3和Fe是固体,不能写在表达式中,故K=
,故答案为:
;
②n(Fe)=
=
=0.2mol,根据方程式可知n(CO)=
n(Fe)=0.3mol,c(CO)=
=0.15mol/L,故可求得v(CO)=
=0.03mol?L-1?min-1,
故答案为:0.03mol?L-1?min-1;
③温度升高
的值增大,平衡逆移,则正方向为放热反应,故Q<0,故答案为:<;
(2)由图1可知PH在4左右时,Fe3+,完全沉淀,而Cu2+还没开始沉淀,故答案为:B;
(3)由Ksp(HgS)=6.4×10-53mol2?L-2求出c(S2-)=
=8×10-27mol?L-1,溶液中c(S2-)相同,再分别利用各自的Ksp求出其阳离子浓度,可求出c(Fe2+):c(Pb2+):c(Hg2+)=6.3:3.4×10-10:6.4×10-35,故答案为:6.3:3.4×10-10:6.4×10-35;
(4)A.根据图2可知电极X的材料是Fe,故A正确;
B.Ag电极应该插入AgNO3溶液,故B正确;
C.原电池工作时,盐桥中的阴离子不断移向负极移动,故C错误;
D.原电池工作时,x为负极,电极反应为:Fe-2e-→Fe2+,故D错误;
故答案为:CD.
| [CO2]3 |
| [CO]3 |
| [CO2]3 |
| [CO]3 |
②n(Fe)=
| m |
| M |
| 11.2g |
| 56g/mol |
| 3 |
| 2 |
| 0.3mol |
| 2L |
| 0.15mol/L |
| 5min |
故答案为:0.03mol?L-1?min-1;
③温度升高
| [CO] |
| [CO2] |
(2)由图1可知PH在4左右时,Fe3+,完全沉淀,而Cu2+还没开始沉淀,故答案为:B;
(3)由Ksp(HgS)=6.4×10-53mol2?L-2求出c(S2-)=
| 6.4×10-53 |
(4)A.根据图2可知电极X的材料是Fe,故A正确;
B.Ag电极应该插入AgNO3溶液,故B正确;
C.原电池工作时,盐桥中的阴离子不断移向负极移动,故C错误;
D.原电池工作时,x为负极,电极反应为:Fe-2e-→Fe2+,故D错误;
故答案为:CD.
点评:本题考查了化学平衡常数、溶度积、原电池等知识,要注意多种离子混合溶液中Ksp的应用.

练习册系列答案
相关题目

 NH 3?H2O
NH 3?H2O NH4++OH-
NH4++OH-