题目内容
常温下的下列情况中,一定能大量共存于同一溶液中的离子组是
| A.使甲基橙呈红色的溶液中:S2-、Cl-、NO3-、Na+ |
| B.使石蕊呈蓝色的溶液中:NH4+、Al3+、NO3-、HCO3- |
| C.由水电离出的c(H+)=1×10 -12 mol·L -1的溶液中:K+、Cl-、NO3-、Na+ |
| D.在0.1mol/L的氯化铁溶液中:Ⅰ一、NH4+、NO3-、Cl- |
C
解析试题分析:A、使甲基橙呈红色的溶液是酸性溶液,在酸性条件下,硝酸根离子具有强氧化性,可以氧化硫离子成硫单质,不能共存,错误;B、使石蕊呈蓝色的溶液,溶液显碱性,不能与氨根离子、铝离子、碳酸氢根离子共存,错误;C、由水电离出的c(H+)=1×10 -12 mol·L -1的溶液,表明水的电离受到了抑制,表明这种溶液可能是酸性,也可能是碱性溶液,但不管是那种情况,该组离子都能共存,正确;D、0.1mol/L的氯化铁溶液,是一种酸性溶液,在这种条件下,硝酸根离子能将碘离子氧化生成碘单质,不能共存。
考点:考查离子的共存。

练习册系列答案
相关题目
下列离子方程式正确的是
| A.Cl2通入水中:Cl2+H2O=2H+ +Cl-+ClO- |
| B.双氧水中加入稀硫酸和KI溶液:H2O2+2H++2I-=I2+2H2O |
C.用铜作电极电解CuSO4溶液:2Cu2++2H2O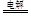 2Cu+O2↑+4H+ 2Cu+O2↑+4H+ |
| D.钢铁发生吸氧腐蚀时,铁作负极被氧化:Fe - 3e- = Fe3+ |
实验室欲配制一种仅含有四种离子(不考虑来源水电离的离子)的溶液,且溶液中四种离子的浓度均相等,能达到此目的的是
| A.Na+、Mg2+、SO42—、Cl— | B.ClO—、I—、NH4+、Ba2+ |
| C.Na+、AlO2—、K+、HCO3— | D.Al3+、K+、SO42—、NO3— |
下列化学方程式及离子方程式中,正确的是( )
| A.钠与CuSO4溶液反应:2Na+Cu2+=Cu+2Na+ |
| B.等物质的量的NaHCO3溶液和Ba(OH)2溶液混合:HCO3-+Ba2++OH-= BaCO3↓+H2O |
| C.Na2O2溶于水产生O2:Na2O2+H2O = 2Na++2OH-+O2↑ |
| D.少量AlCl3溶液滴入过量氨水中:Al3++4NH3?H2O= AlO2- +4NH4+ +2 H2O |
一杯澄清透明的溶液中,已知各离子的浓度均为0.1 mol/L,体积为1 L。可能含有的离子:
阳离子:K+、Fe2+、Ba2+、NH4+ 阴离子:Cl-、NO3—、CO32—、SO42—
向该混合液中加足量稀盐酸,有无色气体生成,且阴离子的种类不变。对该溶液的下列叙述错误的是( )
| A.该溶液一定含有Fe2+、NO3—、Cl- | B.该溶液一定不含K+、NH4+ |
| C.该溶液一定不含CO32—、Ba2+ | D.该溶液可能含有SO42— |
已知电离平衡常数:H2CO3>HClO>HCO3-,氧化性:HClO>Cl2>Br2>Fe3+>I2。下列有关离子反应或离子方程式的叙述中,正确的是( )
| A.向FeI2溶液中滴加少量氯水,反应的离子方程式为2Fe2++Cl2=3Fe3++2Cl- |
| B.向溴水中加入足量氯化亚铁溶液能使溴水变成无色 |
| C.向NaClO溶液中通入少量CO2的离子方程式:2ClO-+CO2+H2O=2HClO+CO32- |
| D.能使pH试纸显深红色的溶液,Fe3+、Cl-、Ba2+、Br-能大量共存 |
含有下列各组离子的溶液中,通入(或加入)过量的某种物质后仍能大量共存的是( )
| A.H+、Ba2+、Fe3+、NO3—,通入SO2气体 |
| B.Ca2+、Cl-、K+、H+,通入CO2气体 |
| C.AlO2—、Na+、Br-、SO42—,通入CO2气体 |
| D.HCO3—、Na+、I-、HS-,加入AlCl3溶液 |

