题目内容
8.在一个6L的密闭容器中放入3mol X和2molY,在一定条件下发生反应4X(g)+3Y(g)?2Q(g)+nR(g),达到平衡后,容器内的压强比原来增加5%,X浓度减小$\frac{1}{3}$,则该反应方程式中的n值是( )| A. | 3 | B. | 4 | C. | 5 | D. | 6 |
分析 在相同温度和体积的容器中,气体的物质的量之比等于压强之比,为便于计算,可假设通入3molX 气体和2molY气体,根据X的浓度变化计算参加反应的X的物质的量,利用三段式计算平衡时各组分的物质的量,再根据反应前后的压强关系列方程,据此进行解答.
解答 解:假设通入3molX 气体和2molY气体,X的浓度减小$\frac{1}{3}$,则反应的X为1mol,则:
4X(g)+3Y(g)═2Q(g)+nR(g)
起始:3mol 2mol 0 0
转化:1mol 0.75mol 0.5mol 0.25nmol
平衡:2mol 1.25mol 0.5mol 0.25nmol
在相同温度和体积的容器中,气体的物质的量之比等于压强之比,反应达到平衡后,容器内温度不变,混合气体的压强比原来增加5%,
则:(2+1.25+0.5+0.25n)-5=5×5%,
解得:n=6,
故选D.
点评 本题考查化学平衡的计算,题目难度中等,明确在相同温度和体积的容器中气体的物质的量之比等于压强之比为解答关键,注意掌握三段式在化学平衡计算中的应用方法,试题培养了学生的化学计算能力.

练习册系列答案
相关题目
18.已知含有羧基的物质具有和乙酸相似的性质.巴豆酸是一种对胃肠道有强烈刺激性、对呼吸中枢和心脏有麻痹作用的有机酸,其结构简式为CH3-CH═CH-COOH,一定条件下下列物质中能与巴豆酸反应的是( )
①氯化氢 ②溴水 ③纯碱溶液 ④乙醇 ⑤酸化的KMnO4溶液.
①氯化氢 ②溴水 ③纯碱溶液 ④乙醇 ⑤酸化的KMnO4溶液.
| A. | 只有②④⑤ | B. | 只有①③④ | C. | 只有①②③④ | D. | ①②③④⑤ |
19.要鉴别己烯中是否混有少量甲苯,正确的实验方法是( )
| A. | 加入浓硫酸与浓硝酸后加热 | |
| B. | 先加足量溴水,然后再加入酸性高锰酸钾溶液 | |
| C. | 点燃这种液体,然后再观察火焰的颜色 | |
| D. | 先加足量的酸性高锰酸钾溶液,然后再加入溴水 |
16.已知反应:X+Y═M+N为放热反应,则下列说法正确的是( )
| A. | Y的能量一定高于N | |
| B. | 因为该反应为放热反应,故不必加热就可发生 | |
| C. | X和Y的总能量一定高于M和N的总能量 | |
| D. | 断裂X和Y的化学键所吸收的能量一定高于形成M和N的化学键所放出的能量 |
3.下列说法中正确的是( )
| A. | 0.1 mol•L-1盐酸和0.1 mol•L-1硫酸与2 mol•L-1 NaOH溶液反应速率相同 | |
| B. | 大理石块和大理石粉与0.1 mol•L-1盐酸反应的速率相同 | |
| C. | 等量的Mg粉、Al粉和0.1 mol•L-1盐酸反应速率相同 | |
| D. | 0.1 mol•L-1盐酸和0.1 mol•L-1硝酸与相同形状和大小的大理石反应的速率相同 |
17.下列说法中不正确的是( )
| A. | 钠和水的反应比镁剧烈的多 | B. | 氟的非金属性比氯强 | ||
| C. | 磷酸的酸性比硝酸强 | D. | 水的热稳定性比氨强 |
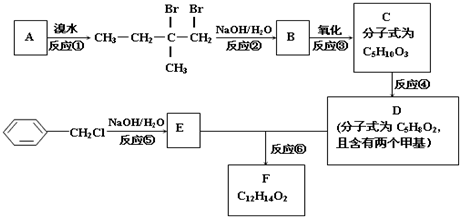
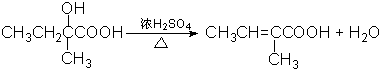 ;
;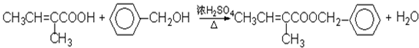 .
.