题目内容
已知某溶液中只存在OH-、H+、Na+、CH3COO-四种离子,某同学推测其离子浓度大小顺序有如下四种关系:
①c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
②c(Na+)>c(OH-)>c(CH3COO-)>c(H+)
③c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
④c(CH3COO-)>c(H+)>c(Na+)>c(OH-)
填写下列空白:
(1)若溶液中溶解了一种溶质,则该溶质是
(2)若上述关系①是正确的,则溶液中的溶质为
(3)若该溶液是由体积相等的NaOH溶液和醋酸混合而成,且恰好呈中性,则混合前c(NaOH)
①c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
②c(Na+)>c(OH-)>c(CH3COO-)>c(H+)
③c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
④c(CH3COO-)>c(H+)>c(Na+)>c(OH-)
填写下列空白:
(1)若溶液中溶解了一种溶质,则该溶质是
CH3COONa
CH3COONa
,则该溶液中四种离子浓度的大小顺序符合上述4种关系中的③
③
.(填序号)(2)若上述关系①是正确的,则溶液中的溶质为
CH3COONa与CH3COOH
CH3COONa与CH3COOH
;若上述关系②是正确的,则溶液中的溶质为CH3COONa与NaOH
CH3COONa与NaOH
.(3)若该溶液是由体积相等的NaOH溶液和醋酸混合而成,且恰好呈中性,则混合前c(NaOH)
小于
小于
c(CH3COOH)(填“大于”、“小于”、或“等于”,下同),混合后溶液中C(CH3COO-)等于
等于
C(Na+).分析:①溶液呈酸性,醋酸过量;
②溶液呈碱性,为CH3COONa与NaOH的化合物;
③溶液呈碱性,可能为CH3COONa溶液;
④溶液呈酸性,醋酸过量.
②溶液呈碱性,为CH3COONa与NaOH的化合物;
③溶液呈碱性,可能为CH3COONa溶液;
④溶液呈酸性,醋酸过量.
解答:解:①溶液呈酸性,醋酸过量;
②溶液呈碱性,c(OH-)>c(CH3COO-),应为CH3COONa与NaOH的混合物;
③溶液呈碱性,可能为CH3COONa溶液,也可能为CH3COONa与CH3COOH的混合物;
④溶液呈酸性,醋酸过量,c(H+)>c(Na+),说明所加入NaOH很少.
(1)若溶液中溶解了一种溶质,则该溶质是只能是CH3COONa,则该溶液中四种离子浓度的大小顺序
c(Na+)>c(CH3COO-)>c(OH-)>c(H+),故答案为:CH3COONa;③;
(2)若上述关系①是正确的,溶液呈酸性,醋酸过量溶液中的溶质为CH3COONa与CH3COOH的混合物,若上述关系②是正确的,溶液呈碱性,c(OH-)>c(CH3COO-),应为CH3COONa与NaOH的混合物,
故答案为:CH3COONa与CH3COOH;CH3COONa与NaOH;
(3)若该溶液是由体积相等的NaOH溶液和醋酸混合而成,且恰好呈中性,则溶液中c(H+)=c(OH-),根据溶液呈电中性,则C(CH3COO-)=c(Na+),由于醋酸为弱酸,
则混合前c(CH3COOH)>c(NaOH),故答案为:小于;等于.
②溶液呈碱性,c(OH-)>c(CH3COO-),应为CH3COONa与NaOH的混合物;
③溶液呈碱性,可能为CH3COONa溶液,也可能为CH3COONa与CH3COOH的混合物;
④溶液呈酸性,醋酸过量,c(H+)>c(Na+),说明所加入NaOH很少.
(1)若溶液中溶解了一种溶质,则该溶质是只能是CH3COONa,则该溶液中四种离子浓度的大小顺序
c(Na+)>c(CH3COO-)>c(OH-)>c(H+),故答案为:CH3COONa;③;
(2)若上述关系①是正确的,溶液呈酸性,醋酸过量溶液中的溶质为CH3COONa与CH3COOH的混合物,若上述关系②是正确的,溶液呈碱性,c(OH-)>c(CH3COO-),应为CH3COONa与NaOH的混合物,
故答案为:CH3COONa与CH3COOH;CH3COONa与NaOH;
(3)若该溶液是由体积相等的NaOH溶液和醋酸混合而成,且恰好呈中性,则溶液中c(H+)=c(OH-),根据溶液呈电中性,则C(CH3COO-)=c(Na+),由于醋酸为弱酸,
则混合前c(CH3COOH)>c(NaOH),故答案为:小于;等于.
点评:本题考查离子浓度的大小比较以及弱电解质的电离等问题,题目难度较大,注意根据溶液离子浓度的关系结合弱电解质的电离和盐类的水解等知识解答.

练习册系列答案
相关题目
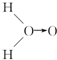 (式中O→O表示配位键,在化学反应中O→O键遇到还原剂时易断裂)
(式中O→O表示配位键,在化学反应中O→O键遇到还原剂时易断裂)
 的沸点高于
的沸点高于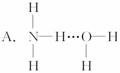

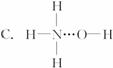

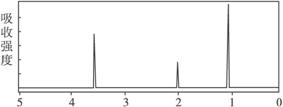
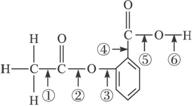
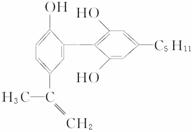


 子反应式: 。
子反应式: 。