题目内容
4.已知下列两个热化学方程式2H2O(l)=2H2(g)+O2(g);△H=+571.6kJ
C3H8(g)+5O2(g)=3CO2(g)+4H2O(l);△H=-2220.0kJ
实验测得氢气和丙烷的混和气体共5mol完全燃烧时放热3847kJ,则混和气体中氢气与丙烷的体积比是( )
| A. | 1:3 | B. | 3:1 | C. | 1:4 | D. | 1:1 |
分析 先根据方程式求出H2和C3H8的燃烧热,设H2的物质的量为nmol,则C3H8的物质的量为5mol-n,根据放出的热量列方程式解答即可.
解答 解:设混合气中H2的物质的量为n,则C3H8的物质的量为5mol-n,
由热化学方程式可知1molH2、1molC3H8完全燃烧放出的热量分别为285.8kJ、2220kJ,
则:285.8kJ/mol×n+2220.0kJ/mol×(5mol-n)=3847kJ,
解得:n=3.75mol,
C3H8的物质的量为5mol-3.75mol=1.25mol,
相同条件下气体的体积之比等于物质的量之比,
所以混合气体中H2与C3H8的体积比=物质的量之比=3.75 mol:1.25 mol=3:1,
故选B.
点评 本题以热化学反应方程式为载体考查根据方程式计算,题目难度中等,试题侧重考查学生的分析能力及计算能力,注意熟练掌握基本公式并能够灵活运用.

练习册系列答案
相关题目
19.下列实验操作或对实验事实的叙述中存在错误的是( )
| A. | 用50mL酸式滴定管准确量取23.20mL酸性KMnO4溶液,放入锥形瓶中待用 | |
| B. | 制备AlCl3、FeCl3、CuCl2均不能采用将溶液直接蒸干的方法 | |
| C. | 使用pH试纸测定溶液pH时先润湿,则测得溶液的pH会发生变化 | |
| D. | 用惰性电极电解NaCl溶液一段时间后,再加入盐酸可使溶液与原溶液完全一样 |
13.煤化工是以煤为原料,经过化学加工使煤转化为气体、液体、固体燃料以及各种化工产品的工业过程.
(1)将水蒸气通过红热的碳即可产生水煤气.反应为:C(s)+H2O(g)?CO(g)+H2(g).一定温度下,在一个容积不变的密闭容器中,发生上述反应,下列能判断该反应达到化学平衡状态的是(填字母,下同).
a.容器中的压强不变
b.1mol H-H 键断裂的同时断裂2mol H-O 键
c.混合气体密度不变
d.c(CO)=c(H2)
(2)将不同量的CO(g)和H2O(g)分别通入到体积为2L 的恒容密闭容器中,进行反应CO(g)+H2O(g)?CO2(g)+H2(g),得到数据如下:
实验中以v(CO2) 表示的反应速率为,达平衡时CO 的体积分数为40%.
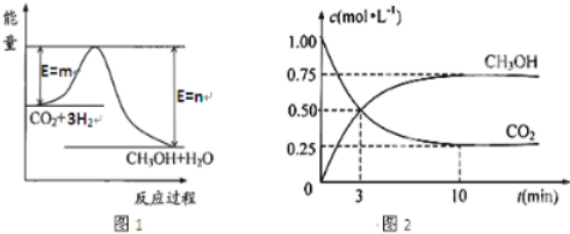
(3)目前工业上有一种方法是用CO2来生产甲醇.一定条件下,在体积为1L 的恒容密闭容器中,发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g).
为了加快反应速率,可采取什么措施(写两条)升温、使用催化剂.
(1)将水蒸气通过红热的碳即可产生水煤气.反应为:C(s)+H2O(g)?CO(g)+H2(g).一定温度下,在一个容积不变的密闭容器中,发生上述反应,下列能判断该反应达到化学平衡状态的是(填字母,下同).
a.容器中的压强不变
b.1mol H-H 键断裂的同时断裂2mol H-O 键
c.混合气体密度不变
d.c(CO)=c(H2)
(2)将不同量的CO(g)和H2O(g)分别通入到体积为2L 的恒容密闭容器中,进行反应CO(g)+H2O(g)?CO2(g)+H2(g),得到数据如下:
| 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| H2O | CO | H2 | CO | |
| 2 | 4 | 1.6 | 2.4 | 5 |
(3)目前工业上有一种方法是用CO2来生产甲醇.一定条件下,在体积为1L 的恒容密闭容器中,发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g).
为了加快反应速率,可采取什么措施(写两条)升温、使用催化剂.


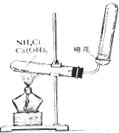 如图是实验室制取氨气的装置图,请回答下列问题:
如图是实验室制取氨气的装置图,请回答下列问题: