题目内容
【题目】一定温度下,将足量的AgCl分别放入下列物质中,AgCl的溶解度由大到小的排列顺序是( )
①20 mL 0.01 mol·L-1KCl溶液 ②30 mL 0.02 mol·L-1CaCl2溶液 ③40 mL 0.03 mol·L-1HCl溶液 ④10 mL蒸馏水 ⑤50 mL 0.05 mol·L-1AgNO3溶液
A. ①>②>③>④>⑤ B. ④>①>③>②>⑤
C. ⑤>④>②>①>③ D. ④>③>⑤>②>①
【答案】B
【解析】
AgCl饱和溶液中存在AgCl(aq)![]() Ag+(aq)+Cl-(aq),AgCl的溶解度大小取决于溶液中c(Ag+)或c(Cl-),c(Ag+)或c(Cl-)越小,AgCl的溶解度越大。
Ag+(aq)+Cl-(aq),AgCl的溶解度大小取决于溶液中c(Ag+)或c(Cl-),c(Ag+)或c(Cl-)越小,AgCl的溶解度越大。
①c(Cl-)=0.01mol/L,②c(Cl-)=0.04mol/L,③c(Cl-)=0.03mol/L,④c(Ag+)或c(Cl-)为0,⑤c(Ag+)=0.05mol/L,则AgCl的溶解度由大到小排列顺序是④>①>③>②>⑤,故合理选项是B。

 阅读快车系列答案
阅读快车系列答案【题目】用酸性KMnO4和H2C2O4(草酸)反应研究影响反应速率的因素。一实验小组欲通过测定单位时间内生成CO2的速率,探究某种影响化学反应速率的因素,设计实验方案如下(KMnO4溶液已酸化):
实验序号 | A溶液 | B溶液 |
① | 20 mL 0.1 mol·L-1H2C2O4溶液 | 30 mL 0.01 mol·L-1KMnO4溶液 |
② | 20 mL 0.2 mol·L-1H2C2O4溶液 | 30 mL 0.01 mol·L-1KMnO4溶液 |

(1)该反应的离子方程式 。(已知H2C2O4是二元弱酸)
(2)该实验探究的是 因素对化学反应速率的影响。相同时间内针筒中所得CO2的体积大小关系是 < (填实验序号)。
(3)若实验①在2 min末收集了2.24 mL CO2(标准状况下),则在2 min末, c(MnO4-)=__________mol/L(假设混合液体积为50 mL)
(4)除通过测定一定时间内CO2的体积来比较反应速率,本实验还可通过测定 来比较化学反应速率。(一条即可)
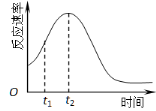 (5)小组同学发现反应速率总是如图,其中t1~t2时间内速率变快的主要原因可能是:
(5)小组同学发现反应速率总是如图,其中t1~t2时间内速率变快的主要原因可能是:

① ;② 。
【题目】下表是元素周期表的前四周期,请回答有关问题:(相关均用具体化学用语回答)
1 | ① | |||||||
2 | ② | ③ | ④ | |||||
3 | ⑤ | ⑥ | ⑦ | ⑧ | ||||
4 | ⑨ | ⑩ | ||||||
(1)元素⑤⑥⑦的简单离子半径大小顺序__________;②在元素周期表位置________;③的简单氢化物和⑧的氢化物混合形成的化合物电子式__________。
(2)⑤其最高价氧化物水合物和⑥的最高价氧化物反应的离子方程式_______
(3)用电子式表示元素①和⑧形成的化合物的形成过程__________。
(4)④、⑧、⑩的氢化物沸点最高的是__________,原因是__________。
(5)由②和①组成最简单物质与O2和⑨的最高价氧化物对应的水化物的水溶液组成燃料电池,写出电池的负极反应式__________。



