题目内容
(12分)Ⅰ.某学生用0.1mol/L KOH溶液滴定未知浓度的盐酸溶液,其操作可分解为如下几步:
| A.移取20.00mL待测的盐酸溶液注入洁净的锥形瓶,并加入2-3滴酚酞 |
| B.用标准溶液润洗滴定管2-3次 |
| C.把盛有标准溶液的碱式滴定管固定好,调节液面使滴定管尖嘴充满溶液 |
| D.取标准KOH溶液注入碱式滴定管至0刻度以上2-3cm |
(F)把锥形瓶放在滴定管的下面,用标准KOH溶液滴定至终点,记下滴定管液面的刻度
完成以下填空:
(1)正确操作的顺序是(用序号字母填写)______________________.
(2)实验中眼睛注视_______ ,直至滴定终点。判断到达终点的现象是___________ 。
(3)滴定前平视KOH液面,刻度为amL,滴定后俯视液面刻度为bmL,则(b-a)mL比实际消耗KOH溶液体积 (填“多”或“少”)。根据(b-a)mL计算得到的待测浓度,比实际 填“大”或“小”)。
(4)若酸式滴定管没有用盐酸润洗,对测定结果有何影响____________(填“偏大”、“偏小”或“无影响”,其他操作均正确)。
(1)BDCEAF
(2)锥形瓶中溶液的颜色变化;锥形瓶中溶液的颜色由无色变浅红且保持30秒内不褪色。
(3)少,小 (4)偏小
解析试题分析:(1)中和滴定按照检漏、洗涤、润洗、装液、取待测液并加指示剂、滴定等顺序操作,故答案为:BDCEAF;(2)实验中眼睛注视锥形瓶中溶液的颜色变化;判断到达终点的现象是锥形瓶中溶液的颜色由无色变浅红且保持30秒内不褪色。(3)滴定前平视KOH液面,刻度为amL,滴定后俯视液面,读数读小了,刻度为bmL,则(b-a)mL比实际消耗KOH溶液体积少。根据(b-a)mL计算得到的待测浓度,比实际偏小;(4)若酸式滴定管没有用盐酸润洗,则盐酸的浓度降低,导致消耗NaOH少,测定结果偏小。
考点:考查酸碱中和滴定。

 名校课堂系列答案
名校课堂系列答案下列变化需要吸收能量的是
| A.1s22s22p63s1→1s22s22p6 | B.3s23p5→3s23p6 |
| C.2p2x2p1y2p1z→2p1x2p1y2p2z | D.2H→H—H |
常温时,将pH=13的强碱溶液和pH=2的强酸溶液混合,所得溶液的pH=11,则强碱溶液和强酸溶液的体积之比为:
| A.1:9 | B.9:1 | C.10:1 | D.1:10 |
下列说法正确的是
| A.强电解质一定易溶于水 |
| B.钢铁在海水中发生电化腐蚀时,铁是负极被氧化 |
| C.对可逆反应,升高温度一定存在v(正)>v(逆) |
| D.相同浓度时,强酸中水的电离程度比弱酸的水的电离程度小 |
(6分)某学生用0.100 mol·L-1的NaOH标准溶液滴定未知浓度的盐酸,
其操作可分解为如下几步:
| A.移取20.00 mL待测盐酸溶液注入洁净的锥形瓶,并加入2~3滴酚酞; |
| B.用标准溶液润洗滴定管2~3次; |
| C.把盛有标准溶液的碱式滴定管固定好,调节滴定管尖嘴使之充满溶液; |
| D.取标准KOH溶液注入碱式滴定管至刻度“0”以上2~3 mL; |
F.把锥形瓶放在滴定管的下面,用标准NaOH溶液滴定至终点并记下滴定管液面的刻度。
就此实验完成填空:
(1)正确操作步骤的顺序是(用字母序号填写) 。
(2)上述A步骤操作之前,若先用待测溶液润洗锥形瓶,则滴定结果 (填“偏高”“偏低”或“不变”)。
(3)判断到达滴定终点的实验现象是 。
11分)(1)下图分别是温度计、量筒、滴定管的一部分,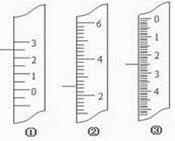
则:量筒应该是 读数为 mL,滴定管应该是 读数为 mL,温度计应该是 。
(2)实验室有一瓶混有氯化钠的氢氧化钠固体试剂,为了验证其纯度,用已知浓度的盐酸进行滴定,试回答下列问题:
①称取一定质量固体试剂配制100mL溶液。
②将标准盐酸装在25.00mL 滴定管中,调节液面位置在 ,并记下刻度。
③取20.00mL待测液,待测定。该项实验操作的主要仪器有 。
用 试剂作指示剂。
④下列实验操作会引起氢氧化钠含量偏高的是 。
| A.滴定前滴定管尖嘴有气泡,滴定后滴定管尖嘴无气泡 |
| B.中和滴定时,锥形瓶内有少量蒸馏水 |
| C.酸式滴定管用蒸馏水洗后,用标准液润洗2-3次 |
| D.读取滴定管终点读数时,仰视刻度线 |
下列物质中,能与碘水反应显蓝色的是
| A.酒精 | B.醋酸 | C.淀粉 | D.葡萄糖 |


