题目内容
14.室温下单质碘为固体,单质氯为气体.尽管两者存在的状态不同,但两者( )| A. | 均含离子键 | B. | 都含离子键和共价键 | ||
| C. | 均含共价键 | D. | 均可与H2形成离子化合物 |
分析 卤素单质都是由共价键形成的非极性分子,与H2形成共价化合物,由此分析解答.
解答 解:A、均含共价键,而不含离子键,故A错误;
B、均只含共价键,而不含离子键,故B错误;
C、均含共价键,故C正确;
D、与H2形成共价化合物,而不是离子化合物,故D错误;
故选C.
点评 本题考查了共价键和离子键的判断,明确离子键和共价键的形成及区别是解本题关键,难度不大.

练习册系列答案
相关题目
5.下列离子方程式正确的是( )
| A. | 高锰酸钾溶液与乙二酸(草酸)反应:2MnO4-+5C2O42-+16H+→2Mn2++10CO2↑+8H2O | |
| B. | 苯酚与碳酸钠溶液: +CO32-→ +CO32-→ +H2CO3 +H2CO3 | |
| C. | 等体积等物质的量浓度的NH4Fe(SO4)2和Ba(OH)2混合:2Fe3++3SO42-+3Ba2++6OH-═3BaSO4↓+2Fe(OH)3↓ | |
| D. | 在强碱性溶液中次氯酸钠与Fe(OH)3反应生成Na2FeO4:3ClO-+2Fe(OH)3═2FeO42-+3Cl-+H2O+4H+ |
2.甲同学进行Fe2+还原性的实验,针对异常现象进行探究.
步骤一:制取FeCl2溶液.向0.1mol•L-1 FeCl3溶液中加足量铁粉振荡,静置后取上层清液,测得pH<1.
实验二:向1mL FeCl2溶液中滴加2滴0.1mol•L-1KSCN溶液,无现象;再滴加5滴5% H2O2溶液(物质的量浓度约为1.5mol•L-1、pH约为5),观察到溶液变红,大约10秒左右红色褪去,有气体生成(经检验为O2).
(1)用离子方程式表示步骤二中溶液变红的原因:2Fe2++H2O2+2H+═2Fe3++2H2O、Fe3++3SCN?Fe(SCN)3.
(2)甲探究步骤二中溶液褪色的原因:
Ⅰ.取褪色后溶液两份,一份滴加FeCl3溶液无现象;另一份滴加KSCN溶液出现红色;
Ⅱ.取褪色后溶液,滴加盐酸和BaCl2溶液,产生白色沉淀.
Ⅲ.向2mL 0.1mol•L-1 FeCl3溶液中滴加2滴0.1mol•L-1KSCN溶液,变红,通入O2,无明显变化.
①实验I的说明溶液红色褪去是因为SCN-发生了反应而不是Fe3+发生反应;
②实验III的目的是排除H2O2分解产生的O2氧化SCN-的可能.
得出结论:溶液褪色的原因是酸性条件下H2O2将SCN-氧化成SO42-.
(3)甲直接用FeCl2•4H2O配制0.15mol•L-1的FeCl2溶液,重复步骤二中的操作,发现液体红色并未褪去.进一步探究其原因:
Ⅰ.用激光笔分别照射红色液体和滴加了KSCN溶液的FeCl3溶液,前者有丁达尔效应,后者无.测所配FeCl2溶液的pH,约为3.由此,乙认为红色不褪去的可能原因是H2O2将Fe2+氧化为Fe3+,pH增大促进Fe3+水解形成红色Fe(OH)3胶体.
Ⅱ.查阅资料后推测,红色不褪去的原因还可能是pH较大时H2O2不能氧化SCN-.乙利用上述部分试剂,通过实验排除了这一可能.乙的实验操作及现象是:
步骤一:制取FeCl2溶液.向0.1mol•L-1 FeCl3溶液中加足量铁粉振荡,静置后取上层清液,测得pH<1.
实验二:向1mL FeCl2溶液中滴加2滴0.1mol•L-1KSCN溶液,无现象;再滴加5滴5% H2O2溶液(物质的量浓度约为1.5mol•L-1、pH约为5),观察到溶液变红,大约10秒左右红色褪去,有气体生成(经检验为O2).
(1)用离子方程式表示步骤二中溶液变红的原因:2Fe2++H2O2+2H+═2Fe3++2H2O、Fe3++3SCN?Fe(SCN)3.
(2)甲探究步骤二中溶液褪色的原因:
Ⅰ.取褪色后溶液两份,一份滴加FeCl3溶液无现象;另一份滴加KSCN溶液出现红色;
Ⅱ.取褪色后溶液,滴加盐酸和BaCl2溶液,产生白色沉淀.
Ⅲ.向2mL 0.1mol•L-1 FeCl3溶液中滴加2滴0.1mol•L-1KSCN溶液,变红,通入O2,无明显变化.
①实验I的说明溶液红色褪去是因为SCN-发生了反应而不是Fe3+发生反应;
②实验III的目的是排除H2O2分解产生的O2氧化SCN-的可能.
得出结论:溶液褪色的原因是酸性条件下H2O2将SCN-氧化成SO42-.
(3)甲直接用FeCl2•4H2O配制0.15mol•L-1的FeCl2溶液,重复步骤二中的操作,发现液体红色并未褪去.进一步探究其原因:
Ⅰ.用激光笔分别照射红色液体和滴加了KSCN溶液的FeCl3溶液,前者有丁达尔效应,后者无.测所配FeCl2溶液的pH,约为3.由此,乙认为红色不褪去的可能原因是H2O2将Fe2+氧化为Fe3+,pH增大促进Fe3+水解形成红色Fe(OH)3胶体.
Ⅱ.查阅资料后推测,红色不褪去的原因还可能是pH较大时H2O2不能氧化SCN-.乙利用上述部分试剂,通过实验排除了这一可能.乙的实验操作及现象是:
| 步骤 | 试剂及操作 | 现 象 |
| i | 取2 mL BaCl2溶液,滴加2滴0.1 mol•L-1KSCN溶液和5滴5% H2O2溶液 | 生成白色沉淀 |
| ii | 向i所得溶液中滴加0.1mol•L-1 FeCl3溶液 | 无明显现象 |
9.对下列物质中锰元素化合价的判断,正确的是( )
| A. | KMnO4中为+3 | B. | MnSO4中为-2 | C. | K2MnO4中为+6 | D. | MnO2中为+2 |
19.组成为C6H4S4的物质有吸收微波的功能,可在军事上用做隐形飞机的涂层.下列关于C6H4S4的说法不正确的是( )
| A. | 该物质为有机物 | B. | 该物质为无机物 | ||
| C. | 该物质由三种元素组成 | D. | 该物质燃烧产物可能含CO2 |
6.下列物质属于纯净物的是( )
| A. | 汽油 | B. | 红酒 | C. | 干冰 | D. | 碘酒 |
17.短周期元素X、Y、Z、M、W的原子序数增大,X的气态氰化物能使湿润的红色石蕊试纸变蓝,X与W最外层电子数之和等于Y最外层电子数的2倍,在短周期主族元素中Z的原子半径最大,M的最外层电子数是电子层数的2倍,下列说法不正确的是( )
| A. | Y的气态氢化物比X的稳定 | |
| B. | 元素M存在多种同素异形体 | |
| C. | Z与Y形成的化合物只含有离子键 | |
| D. | W的最高价氧化物对应水化物的酸性比M的强 |
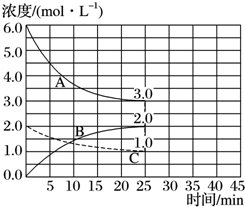 (1)目前工业合成氨的原理是N2(g)+3H2(g)?2NH3(g)△H=-93.0kJ•mol-1.
(1)目前工业合成氨的原理是N2(g)+3H2(g)?2NH3(g)△H=-93.0kJ•mol-1.