题目内容
下列物质除杂(括号内物质为杂质)的方法及试剂都正确的是( )
| 物质 | 方法 | 试剂 | |
| A | CO2(SO2) | 洗气 | 氢氧化钠溶液 |
| B | AlCl3(MgCl2) | 过滤 | 氢氧化钠溶液 |
| C | 水(乙醇) | 萃取、分液 | 乙酸 |
| D | Fe(Al) | 过滤 | 过量氢氧化钠溶液 |
| A、A | B、B | C、C | D、D |
考点:物质的分离、提纯的基本方法选择与应用,物质的分离、提纯和除杂
专题:化学实验基本操作
分析:A.二者均与NaOH溶液反应;
B.二者均与NaOH溶液反应;
C.加乙酸引入新杂质,且不分层;
D.Al与NaOH溶液反应,而Fe不能.
B.二者均与NaOH溶液反应;
C.加乙酸引入新杂质,且不分层;
D.Al与NaOH溶液反应,而Fe不能.
解答:
解:A.二者均与NaOH溶液反应,不能除杂,应选饱和碳酸氢钠溶液、洗气法分离,故A错误;
B.二者均与NaOH溶液反应,应先加足量NaOH溶液过滤后,向滤液中加适量盐酸即可,故B错误;
C.加乙酸引入新杂质,且不分层,应利用蒸馏法分离,故C错误;
D.Al与NaOH溶液反应,而Fe不能,则加NaOH溶液后过滤分离,故D正确;
故选D.
B.二者均与NaOH溶液反应,应先加足量NaOH溶液过滤后,向滤液中加适量盐酸即可,故B错误;
C.加乙酸引入新杂质,且不分层,应利用蒸馏法分离,故C错误;
D.Al与NaOH溶液反应,而Fe不能,则加NaOH溶液后过滤分离,故D正确;
故选D.
点评:本题考查物质的分离、提纯,侧重于学生的分析能力和元素化合物知识的考查,为高频考点,注意把握物质的性质的异同,把握相关方程式的书写,学习中注意相关基础知识的积累,难度不大.

练习册系列答案
 教材全解字词句篇系列答案
教材全解字词句篇系列答案
相关题目
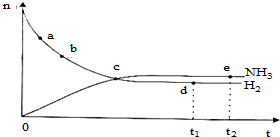 合成氨工业对国民经济和社会发展具有重要的意义.对于密闭容器中的反应:N2(g)+3H2(g)═2NH3(g)△H<0,673K,30M Pa下n(NH3)和n(H2)随时间变化的关系如图所示.下列叙述正确的是( )
合成氨工业对国民经济和社会发展具有重要的意义.对于密闭容器中的反应:N2(g)+3H2(g)═2NH3(g)△H<0,673K,30M Pa下n(NH3)和n(H2)随时间变化的关系如图所示.下列叙述正确的是( )| A、点a的正反应速率比点b的大 |
| B、点c处反应达到平衡 |
| C、点d(t1时刻)和点e(t2时刻)处n(N2)不一样 |
| D、点c处用氨气的浓度表示的速率等于用氢气的浓度表示的速率 |
某学生配制一定物质的量浓度的氢氧化钠溶液后,经测定发现溶液浓度偏低.该学生找出以下原因,其中不会使溶液浓度偏低的是( )
| A、容量瓶刚用蒸馏水洗净,没有烘干 |
| B、没有用蒸馏水洗烧杯2-3次,并将洗液移入容量瓶中 |
| C、定容时滴加蒸馏水先使液面略高于刻度线,再吸出少量水使液面凹面与刻度线相切 |
| D、定容时仰视刻度线 |
进行化学实验,观察实验现象,通过分析推理得出正确的结论是化学学习的方法之一.对下列实验事实的解释不正确的是( )
| A、某溶液中加入稀硫酸再加入铜粉,共热,铜粉溶解且有红棕色气体产生,说明原溶液中含有NO3- |
| B、浓硝酸在光照条件下变黄,说明浓硝酸不稳定,有有色产物生成且能溶于浓硝酸 |
| C、某溶液中加入NaOH溶液,加热能产生使湿润的红色石蕊试纸变蓝的气体,说明原溶液中含有NH4+ |
| D、在KI淀粉溶液中通入氯气,溶液变蓝,说明氯气能与淀粉发生显色反应 |
某有机物的结构简式为CH3CHClCH═CH-CHO,下列各项中,该有机物不可能发生的化学反应是( )
①氧化反应 ②取代反应 ③加成反应 ④消去反应 ⑤还原反应⑥酯化反应 ⑦水解反应 ⑧聚合反应.
①氧化反应 ②取代反应 ③加成反应 ④消去反应 ⑤还原反应⑥酯化反应 ⑦水解反应 ⑧聚合反应.
| A、② | B、④ | C、⑥ | D、⑧ |
下列选用的相关仪器符合实验要求的是( )
A、 存放浓硫酸 |
B、 分离水和乙酸乙酯 |
C、 准确量取9.50mL |
D、 取金属颗粒 |
用NA表示阿伏加德罗常数的值.下列叙述正确的是( )
| A、1molCl2与足量Fe反应,转移的电子数一定为3 NA |
| B、标准状况下,11.2L的SO3所含分子数为0.5NA |
| C、由CO2和O2组成的混合物中共有NA个分子,其中的氧原子数为2NA |
| D、1L浓度为1mol?L-1的Na2CO3溶液中含有NA个CO32- |
 (一)电解饱和食盐水的阳极产物是
(一)电解饱和食盐水的阳极产物是