题目内容
从周期表的第
2、3周期的元素分析来看,位于同一周期元素的原子结构有什么相同之处?它们之间有没有递变规律?怎样递变?为什么有这个递变?从周期表的第
1、17列元素分析来看,同一列(族)元素的原子结构有什么相同之处?它们之间有没有递变规律?怎样递变?为什么有这个递变?
答案:
解析:
解析:
|
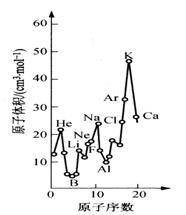
答案:从第 2、3周期元素来看,同周期内元素原子结构的相同点:电子层数相同,但有递变.递变规律:随着原子序数的递增,最外层电子数依次增加,从1增至8;原子半径依次减小,从第1列中的最大值递减到第17列的最小值,第18列特殊例外.发生这个递变的原因是,同周期中,虽然电子数增多会使半径增大,但核电荷越多,核对外层电子的吸引力越大,使原子的内缩力增大,这个方面成为矛盾的主要方面,因此,原子半径越来越小.而从第 1、17列来看,同主族中,最外层电子数相等.但也有递变方面.即随着原子序数的递增,电子层数越来越多,原子半径越来越大.原因是:随着原子序数的递增,虽然核电荷数增大会使半径减小,但电子数的增多,特别是电子层数的增多使半径增大成了矛盾的主要方面.思路:关键要清楚讨论原子结构需要从哪几个角度来看,一般包含:核外电子排布 (重点是电子层数、最外层电子数)、原子半径等内容.关于原子半径的大小,则是要找到影响原子半径大小的因素:有电子层数多少(层多径大)、核电荷数大小(核电荷数越多半径越小)、电子数多少(核外电子数越多半径越大).并要从中找出矛盾的主要方面,然后再来决定递变结果,即规律内容. |

练习册系列答案
 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案
相关题目


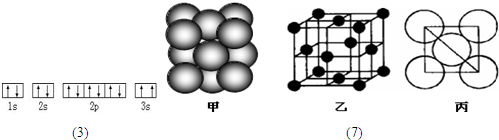

 或
或
 (1)第二周期原子体积最大的元素形成的固态单质属于
(1)第二周期原子体积最大的元素形成的固态单质属于
