题目内容
下图为周期表中原子体积(单质原子的摩尔体积)随原子
序数变化的关系。
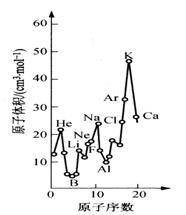 (1)第二周期原子体积最大的元素形成的固态单质属于
(1)第二周期原子体积最大的元素形成的固态单质属于
_________________晶体。第三周期原子体积最小的
元素核外电子排布式为________________________。
(2)试预测下列元素原子体积的关系:Se _____ Br;
Xe _____ Ba(选填 >、 = 或 < )。
(3)从图中可以得出的结论有__________(选填代号)。
a. 同一周期中,原子体积先由大变小,而后又
由小变大
b. 同周期金属元素中,碱金属的原子体积最大
c. 同一主族中从上到下,原子体积一般总是逐
渐减小
(4)由此可见,在元素周期表中,元素性质与它们
所形成的单质和化合物的性质均有周期性变
化规律。试写出一条ⅦA族元素所形成的化
合物某种性质的变化规律:
_____________________________。
(1)分子;1s22s22p63s23p1; (2)<、>; (3)ab;(4)从上到下,气态氢化物稳定性逐渐减弱。
解析:
(1)题,第二周期原子体积最大的是Ne,第三周期原子体积最小的是铝。(2)题,Se与Br比是同周期第VIA跟第VIIA族的比较,可参考O跟F或S跟Cl;Xe跟Ba是稀有气体与下周期的IIA族元素比,可参考Ne跟Mg或Ar跟Ca。第(4)小题只要写出有关非金属性在同主族中递变的具体表现即可。

练习册系列答案
相关题目
(1)已知X、Y、Z为同一短周期的三种元素,其原子的部分电离能(kJ/mol)如下表所示:
①三种元素在周期表中位于第 周期
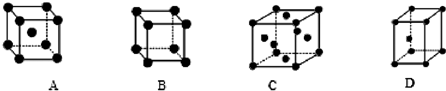
②X晶体采用的堆积方式是下列中 (填字母)
(2)已知N-N、N=N、N≡N键能之比为1.00:2.17:4.90,而C-C、C=C、C≡C键能之比为1.00:1.77:2.34,由此你得出的结论是 .
(3)N2O的等电子体为:①分子 ,②阴离子 ;由此可知N2O的中心原子的杂化类型为 .根据价层电子对互斥模型确定NO2的分子构型为 .
(4)已知铜能形成多种化合物,如硫酸铜的结构如下图所示,请在图中标出水合铜离子中的配位键.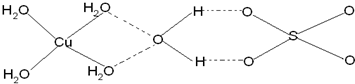
| X | Y | Z | |
| I1 | 496 | 738 | 577 |
| I2 | 4562 | 1451 | 1817 |
| I3 | 6912 | 7733 | 2754 |
| I4 | 9540 | 10540 | 11578 |
②X晶体采用的堆积方式是下列中

(2)已知N-N、N=N、N≡N键能之比为1.00:2.17:4.90,而C-C、C=C、C≡C键能之比为1.00:1.77:2.34,由此你得出的结论是
(3)N2O的等电子体为:①分子
(4)已知铜能形成多种化合物,如硫酸铜的结构如下图所示,请在图中标出水合铜离子中的配位键.

 (2012?南通模拟)Ⅰ.顺铂是美国教授B Rosenberg等人于1969年发现的第一种具有抗癌活性的金属配合物,它的化学式为Pt(NH3)2Cl2.1995年WHO对上百种治癌药物进行排名,顺铂的综合评价列第2位.
(2012?南通模拟)Ⅰ.顺铂是美国教授B Rosenberg等人于1969年发现的第一种具有抗癌活性的金属配合物,它的化学式为Pt(NH3)2Cl2.1995年WHO对上百种治癌药物进行排名,顺铂的综合评价列第2位.


 请回答下列问题:
请回答下列问题: