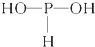题目内容
 味精是烹制菜肴时常用的调味品,其主要成份是谷氨酸钠.谷氨酸钠有鲜味,易溶于水.小明发现某品牌味精包装上部分标注如图所示.
味精是烹制菜肴时常用的调味品,其主要成份是谷氨酸钠.谷氨酸钠有鲜味,易溶于水.小明发现某品牌味精包装上部分标注如图所示.他想测定此味精中NaCl含量是否符合其包装上标注的标准.
【查阅资料】谷氨酸钠存在不影响NaCl性质.
【实验过程】①称取该味精样品5.0g,并溶于蒸馏水;
②加入过量的硝酸银溶液;
③过滤;
④用蒸馏水反复洗涤沉淀多次;
⑤将沉淀烘干、称量,测得固体质量为2.87g.
【回答问题】
(1)过滤操作所需要的仪器除烧杯、铁架台(带铁圈)外,还需要的玻璃仪器是:
(2)此样品中氯化钠的质量分数为
【得出结论】是否符合其包装上标注的标准?
【反思应用】最近专家否认了“味精致癌”的说法.实验表明,味精在100℃时加热半小时,只有0.3%的味精(谷氨酸钠)生成焦谷氨酸钠(有毒),其对人体的影响甚微.对此下列认识不正确的是
A.大量食用味精不利于身体健康
B.尽量避免在菜肴温度较高时使用味精
C.谷氨酸钠受热生成焦谷氨酸钠是物理变化.
考点:探究物质的组成或测量物质的含量
专题:
分析:(1)要使液体与固体分离,用过滤的方法进行,缺少的玻璃仪器是漏斗和玻璃棒;
(2)根据氯化银的质量计算氯化钠的质量,再根据氯化钠的质量分数为
进行计算,再与包装的标准比较判断是否符合标准;
根据题意可以知道,谷氨酸钠在100℃时加热半小时会分解,能够产生有害物质,属于化学变化,所产生的物质对人体的身体健康不利,据此分析.
(2)根据氯化银的质量计算氯化钠的质量,再根据氯化钠的质量分数为
| m(NaCl) |
| m(总) |
根据题意可以知道,谷氨酸钠在100℃时加热半小时会分解,能够产生有害物质,属于化学变化,所产生的物质对人体的身体健康不利,据此分析.
解答:
解:(1)要使液体与固体分离,用过滤的方法进行,缺少的玻璃仪器是漏斗和玻璃棒,
故答案为:漏斗;玻璃棒;
(2)设调料味精中混有的氯化钠的质量为x
NaCl+AgNO3=AgCl↓+NaNO3
58.5 143.5
x 2.87g
=
解得:x=1.17g
味精中氯化钠的质量分数为:
×100%=23.4%
因为23.4%>20%与包装的标准不符,所以不符合标准;故答案为:23.4%;否;
【反思应用】根据题意可以知道,谷氨酸钠在100℃时加热半小时会分解,能够产生有害物质,属于化学变化,所产生的物质对人体的身体健康不利,所以A、B正确,C错误,故选:C.
故答案为:漏斗;玻璃棒;
(2)设调料味精中混有的氯化钠的质量为x
NaCl+AgNO3=AgCl↓+NaNO3
58.5 143.5
x 2.87g
| 58.5 |
| x |
| 143.5 |
| 2.87 |
解得:x=1.17g
味精中氯化钠的质量分数为:
| 1.17 |
| 5 |
因为23.4%>20%与包装的标准不符,所以不符合标准;故答案为:23.4%;否;
【反思应用】根据题意可以知道,谷氨酸钠在100℃时加热半小时会分解,能够产生有害物质,属于化学变化,所产生的物质对人体的身体健康不利,所以A、B正确,C错误,故选:C.
点评:本题主要考查了氯化钠的含量的测定及其味精的成分及性质,明确测量原理是解本题关键,难度较大.

练习册系列答案
相关题目
 X、Y、Z、W均为常见的烃的含氧衍生物且物质类别不同,它们之间存在如图所示的转化关系.下列判断正确的是( )
X、Y、Z、W均为常见的烃的含氧衍生物且物质类别不同,它们之间存在如图所示的转化关系.下列判断正确的是( )| A、X是羧酸,Y是酯 |
| B、Z是醛,W是羧酸 |
| C、Y是醛,W是醇 |
| D、X是醇,Z是酯 |
在短周期中的X和Y两种元素可组成化合物XY3,则下列说法中正确的是( )
| A、若X的原子序数是m,则Y的原子序数必定是m±4 |
| B、XY3一定属于离子化合物 |
| C、X与Y可属于两个不同周期,也可属于同一周期 |
| D、X的原子半径小于Y的原子半径 |
有机物A的化学式为C3H6O2,水解后得到一元酸M和一元醇N,已知M、N的相对分子质量相等,则下列叙述中,不正确的是( )
| A、N、M均不能发生银镜反应 |
| B、M中没有甲基 |
| C、M中含碳量为26.1% |
| D、N中含有甲基 |
用氢氧化钠的标准溶液滴定待测酸的浓度时,用酚酞作指示剂,达到滴定终点时,溶液的颜色变化是( )
| A、由无色变为红色 |
| B、由无色变为浅红色 |
| C、由红色变为无色 |
| D、由红色变为浅红色 |
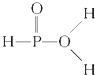
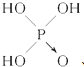 )中三个氢原子都可以跟重水(D2O)中氘原子发生交换,又知次磷酸(H3PO2)也能跟D2O进行氢交换,次磷酸钠(NaH2PO2)却不能再跟D2O发生氢交换,由此推断出次磷酸分子的结构是( )
)中三个氢原子都可以跟重水(D2O)中氘原子发生交换,又知次磷酸(H3PO2)也能跟D2O进行氢交换,次磷酸钠(NaH2PO2)却不能再跟D2O发生氢交换,由此推断出次磷酸分子的结构是( )