题目内容
1.两气体A、B分别为0.6mol、0.5mol.在0.4L密闭容器中发生反应:3A+B?mC+2D,经5min后达到平衡,此时C为0.2mol.又知在此反应时间D的平均反应速率 为0.1mol•L-1•min-1,以下结论正确的是( )| A. | m值为3 | |
| B. | B的转化率为20% | |
| C. | A的平均反应速率为0.1mol•L-1•min-1 | |
| D. | 平衡时反应混合物总物质的量为1mol |
分析 经5min后达到平衡,此时C为0.2mol,v(C)=$\frac{\frac{0.2mol}{0.4L}}{5min}$=0.1mol•L-1•min-1,又知在此反应时间D的平均反应速率为0.1mol•L-1•min-1,由反应速率之比等于化学计量数之比可知,m=2,则
3A+B?2C+2D
开始 0.6 0.5 0 0
转化 0.3 0.1 0.2 0.2
平衡 0.3 0.4 0.2 0.2
结合v=$\frac{△c}{△t}$、转化率=$\frac{转化的量}{开始的量}$×100%计算.
解答 解:经5min后达到平衡,此时C为0.2mol,v(C)=$\frac{\frac{0.2mol}{0.4L}}{5min}$=0.1mol•L-1•min-1,又知在此反应时间D的平均反应速率为0.1mol•L-1•min-1,由反应速率之比等于化学计量数之比可知,m=2,则
3A+B?2C+2D
开始 0.6 0.5 0 0
转化 0.3 0.1 0.2 0.2
平衡 0.3 0.4 0.2 0.2
A.由上述分析可知,m=2,故A错误;
B.B的转化率为$\frac{0.1mol}{0.5mol}$×100%=20%,故B正确;
C.A的平均反应速率为$\frac{\frac{0.3mol}{0.4L}}{5min}$=0.15mol•L-1•min-1,故C错误;
D.该反应为气体的物质的量不变的反应,平衡时反应混合物总物质的量为1.1mol,故D错误;
故选B.
点评 本题考查化学平衡的计算,为高频考点,把握化学平衡三段法、转化率及速率计算等为解答的关键,侧重分析与计算能力的考查,注意化学计量数m的确定,题目难度不大.

| A. | N2将完全转化为NH3 | |
| B. | N2、H2、和NH3的物质的量浓度相等 | |
| C. | N2、H2、和NH3的物质的量浓度不在变化 | |
| D. | 正反应和逆反应的速率都为零 |
| 选项 | 参数 | 比较 | 解释 |
| A | 沸点 | HF<HCl<HI | 组成结构相似的物质,相对分子质量越大沸点越高 |
| B | 半径 | Na+>Al3+>S2- | 同一周期粒子半径随原子序数的递增逐渐减小 |
| C | 酸性 | H2SO3>H2CO3 | 元素的非金属性越强,其含氧酸的酸性越强 |
| D | 还原性 | P3->S2->Cl- | 元素的非金属性越强,简单阴离子的还原性越弱 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 同温、同压下,相同体积的氮气和氦气所含的原子数相等 | |
| B. | 标准状况下,5.6 L以任意比例混合的氯气和氧气所含的原子数为0.5NA | |
| C. | 1 mol氯气和足量NaOH溶液反应转移的电子数为2NA | |
| D. | 常温常压下,22.4 L的NO2和CO2混合气体含有2NA个O原子 |
 碳和碳的化合物在生产、生活中的应用非常广泛,在提倡健康生活已成潮流的今天,“低碳生活”不再只是一种理想,更是一种值得期待的新的生活方式.
碳和碳的化合物在生产、生活中的应用非常广泛,在提倡健康生活已成潮流的今天,“低碳生活”不再只是一种理想,更是一种值得期待的新的生活方式.(1)将CO2与焦炭作用生成CO,CO可用于炼铁等.
①已知:Fe2O3(s)+3C(石墨)═2Fe(s)+3CO(g)△H1=+489.0kJ/mol
C(石墨)+CO2(g)═2CO(g)△H2=+172.5kJ/mol
则CO还原Fe2O3的热化学方程式为Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=-28.5kJ/mol;
②氯化钯(PdCl2)溶液常被应用于检测空气中微量CO.PdCl2被还原成单质,反应的化学方程式为PdCl2+CO+H2O=Pd+CO2+2HCl;
(2)将两个石墨电极插入KOH溶液中,向两极分别通入C3H8和O2构成丙烷燃料电池.
①负极电极反应式是:C3H8+26OH--20e-=3CO32-+17H2O;
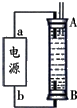
②某同学利用丙烷燃料电池设计了一种电解法制取Fe(OH)2的实验装置(如图所示),通电后,溶液中产生大量的白色沉淀,且较长时间不变色.下列说法中正确的是ABD(填序号)
A.电源中的a一定为正极,b一定为负极
B.可以用NaCl溶液作为电解液
C.A、B两端都必须用铁作电极
D.阴极发生的反应是:2H++2e-=H2↑
(3)将不同量的CO(g)和H2O(g)分别通入体积为2L的恒容密闭容器中,进行反应:CO(g)+H2O(g)?CO2(g)+H2(g),得到如下三组数据:
| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | |
| H2O | CO | CO2 | |||
| 1 | 650 | 2 | 4 | 1.6 | 5 |
| 2 | 900 | 1 | 2 | 0.4 | 3 |
| 3 | 900 | 1 | 2 | 0.4 | 1 |
②实验2中,平衡常数K=$\frac{1}{6}$;
③实验3跟实验2相比,改变的条件可能是使用了催化剂或增大了压强(答一种情况即可).
| A. | 氧化性 | B. | 还原性 | C. | 碱性 | D. | 酸性 |