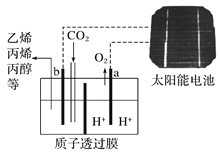
题目内容
【题目】化学键的键能是形成(或断开)1 mol 化学键时释放(或吸收)的能量。已知白磷和 P4O6 的分 子结构如图所示:
现提供以下化学键的键能(kJ·mol-1):P—P:198 P—O:360 O==O:498

若生成 1 mol P4O6,则反应 P4(白磷)+3O2==P4O6 中的能量变化为
A. 吸收 1638 kJ 能量 B. 放出 1638 kJ 能量
C. 吸收 126 kJ 能量 D. 放出 126 kJ 能量
【答案】B
【解析】
反应热△H=反应物总键能-生成物总键能,据此计算判断.注意每摩尔P4中含有6molP-P键.
化学键的键能(kJ·mol-1):P—P:198 P—O:360 O===O:498,反应热△H=反应物总键能-生成物总键能,由图可知:1个P分子中含有6个P-P,1个P4O6分子中含有12个P-O,1mol P4和3mol O2完全反应(P4+3O2=P4O6)生成1molP4O6,所以反应P4+3O2=P4O6的反应热△H=6×198kJ·mol-1+3×498kJ·mol-1-12×360kJ·mol-1=-1638kJ·mol-1,反应放热1638kJ,故选B。

【题目】X、Y、Z、W、R是原子序数依次增大的前四周期元素,这五种元素的相关信息如下:
元素 | 相关信息 |
X | 其中一种核素在考古时常用来鉴定一些文物的年代 |
Y | 原子核外电子有7种不同的运动状态 |
Z | 地壳中含量最高的元素 |
W | 价电子排布式为(n+1)sn(n+1)pn+2 |
R | 基态原子最外能层只有一个电子,其他能层均已充满电子 |
(1)基态R原子的电子排布式为______________________________________。
(2)Y2分子中σ键和π键的数目比为________________。
(3)X、Y、Z三种元素的第一电离能由小到大的顺序为____________(用元素符号表示),元素Y的简单气态氢化物的沸点比元素X的简单气态氢化物沸点高的主要原因是_____________。
(4)元素Z、W组成的微粒WZ42-的空间构型是______,其中W原子的杂化轨道类型为________。
(5)已知Z、R能形成一种化合物,其晶胞结构如图所示,该化合物的化学式为________;若相邻的Z原子和R原子间的距离为a cm,设阿伏加德常数的值为NA,则该晶体的密度为__________g·cm-3(用含a、NA的代数式表示)。