题目内容
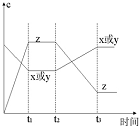 现有X(g)+Y(g)?2Z(g);正反应放热.从反应开始经过t1后达到平衡状态,t2 时由于条件改变,平衡受到破坏,在t3时又达到平衡,据如图回答:从t2→t3的曲线变化是由哪种条件引起的( )
现有X(g)+Y(g)?2Z(g);正反应放热.从反应开始经过t1后达到平衡状态,t2 时由于条件改变,平衡受到破坏,在t3时又达到平衡,据如图回答:从t2→t3的曲线变化是由哪种条件引起的( )分析:由图可知,t2秒改变条件瞬间浓度都不变化,不能是改变浓度与压强,t2秒后X或Y的浓度增大,Z的浓度减小,说明平衡向逆反应方向移动,根据反应的特点和外界条件对平衡的影响来判断.
解答:解:A、由图可知,t2秒瞬间浓度都不变化,不可能是增大X或Y的浓度,且若增大了X或Y的浓度,平衡向正反应方向移动,Z的浓度应增大,不符合,故A错误;
B、增大了体系压强,平衡不移动,X、Y、Z的浓度应增大,故B错误;
C、若增大Z的浓度,改变条件瞬间Z的浓度应增大,平衡时Z的浓度应大于原平衡,图象与实际不相符,故C错误;
D、该反应放热,升高该反应的温度,平衡逆向移动,X或Y的浓度增大,Z的浓度减小,图象符合,故D正确.
故选D.
B、增大了体系压强,平衡不移动,X、Y、Z的浓度应增大,故B错误;
C、若增大Z的浓度,改变条件瞬间Z的浓度应增大,平衡时Z的浓度应大于原平衡,图象与实际不相符,故C错误;
D、该反应放热,升高该反应的温度,平衡逆向移动,X或Y的浓度增大,Z的浓度减小,图象符合,故D正确.
故选D.
点评:本题考查化学平衡的影响因素,题目难度不大,注意化学方程式的前后计量数的关系以及反应放热的特点,以此判断影响平衡移动的因素.

练习册系列答案
 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案
相关题目
现有反应X(g)+Y(g) 2Z(g)△H<0。下图表示从反应开始到t
2Z(g)△H<0。下图表示从反应开始到t s时达到平衡,在t
s时达到平衡,在t s时由于条件变化使平衡破坏,到t
s时由于条件变化使平衡破坏,到t s时又达平衡。则在图中t
s时又达平衡。则在图中t s时改变的条件可能是
s时改变的条件可能是
| A.增大压强 |
| B.使用了催化剂 |
| C.降低温度 |
| D.减小了X或Y的浓度 |
 现有反应X(g)+Y(g)?2Z(g)△H<0.下图表示从反应开始到t1s时达到平衡,在t2s时由于条件变化使平衡破坏,到t3s时又达平衡.则在图中t2s时改变的条件可能是( )
现有反应X(g)+Y(g)?2Z(g)△H<0.下图表示从反应开始到t1s时达到平衡,在t2s时由于条件变化使平衡破坏,到t3s时又达平衡.则在图中t2s时改变的条件可能是( ) 现有可逆反应:X(g)+Y(g)?2Z(g)+W(s)△H<0,如图表示该反应的反应过程.若使a曲线变为b曲线,可采用的措施是( )
现有可逆反应:X(g)+Y(g)?2Z(g)+W(s)△H<0,如图表示该反应的反应过程.若使a曲线变为b曲线,可采用的措施是( ) 2Z(g);正反应放热。从反应开始经过t1后达到平衡状态,t2 时由于条件改变,平衡受到破坏,在t3时又达到平衡,据下图回答:从t2→t3的曲线变化是由哪种条件引起的(
)
2Z(g);正反应放热。从反应开始经过t1后达到平衡状态,t2 时由于条件改变,平衡受到破坏,在t3时又达到平衡,据下图回答:从t2→t3的曲线变化是由哪种条件引起的(
)