题目内容
为达到下表中的实验目的,请选择合适的试剂及实验方法,将其标号填入对应的空格.
供选择的化学试剂及实验方法
A.加入足量铁粉,过滤
B.滴加酚酞试液,观察现象
C.加稀HNO3和AgNO3溶液,观察现象
D.加入NaOH浓溶液加热,观察现象.
| 实 验 目 的 | 试剂及方法 |
| 证明Na2CO3溶液具有碱性 | |
| 鉴别Na2SO4溶液和(NH4)2SO4溶液 | |
| 检验自来水中是否含有Cl- | |
| 除去FeCl2溶液中少量的FeCl3 |
A.加入足量铁粉,过滤
B.滴加酚酞试液,观察现象
C.加稀HNO3和AgNO3溶液,观察现象
D.加入NaOH浓溶液加热,观察现象.
考点:物质的分离、提纯的基本方法选择与应用
专题:
分析:Na2CO3溶液水解显碱性,其pH>7;(NH4)2SO4溶液与NaOH共热生成氨气;Cl-与硝酸银反应生成AgCl白色沉淀;Fe与FeCl3溶液反应生成氯化亚铁,以此来解答.
解答:
解:Na2CO3溶液水解显碱性,其pH>7,则选择B,若变红,可证明;
鉴别Na2SO4溶液和(NH4)2SO4溶液,选择D,(NH4)2SO4溶液与NaOH共热生成氨气,而无现象的为Na2SO4;
Cl-与硝酸银反应生成AgCl白色沉淀,则检验自来水中是否含有Cl-,选择C,若生成沉淀,可证明含有;
Fe与FeCl3溶液反应生成氯化亚铁,则除杂选择A,
故答案为:
.
鉴别Na2SO4溶液和(NH4)2SO4溶液,选择D,(NH4)2SO4溶液与NaOH共热生成氨气,而无现象的为Na2SO4;
Cl-与硝酸银反应生成AgCl白色沉淀,则检验自来水中是否含有Cl-,选择C,若生成沉淀,可证明含有;
Fe与FeCl3溶液反应生成氯化亚铁,则除杂选择A,
故答案为:
| 实 验 目 的 | 试剂及方法 |
| 证明Na2CO3溶液具有碱性 | B |
| 鉴别Na2SO4溶液和(NH4)2SO4溶液 | D |
| 检验自来水中是否含有Cl- | C |
| 除去FeCl2溶液中少量的FeCl3 | A |
点评:本题考查物质的检验和鉴别,为高频考查,把握物质的性质及性质差异为解答的关键,侧重物质鉴别、离子检验及除杂的考查,题目难度不大.

练习册系列答案
相关题目
密闭容器中进行的反应2SO2+O2?2SO3温度保持不变,下列说法中正确的是( )
| A、增加SO2的浓度,正反应速率先增大,后逐渐减小最后保持不变 |
| B、增加O2的浓度,正反应速率逐渐增大 |
| C、增加SO2的浓度,平衡常数增大 |
| D、若平衡时SO2的浓度比原来大,则平衡常数增大 |
在一定温度下的刚性密闭容器中,当下列哪些物理量不再发生变化时,表明下述反应:A(s)+2B(g)?C(g)+D(g)已达到平衡状态( )
| A、混合气体的压强 |
| B、混合气体的体积 |
| C、各气体物质的物质的量浓度 |
| D、气体的总物质的量 |
下列反应中,属于加成反应的是( )
| A、苯乙烯使溴水褪色 |
| B、油脂的皂化反应 |
| C、卤代烃的水解反应 |
| D、乙酸和乙醇发生酯化反应 |
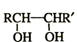


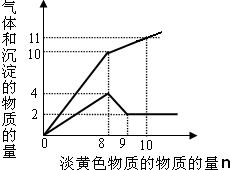 某溶液中只可能含有Fe2+、Mg2+、Cu2+、NH4+、Al3+、Cl-、OH-、CO32-.当加入一种淡黄色固体并加热时,有刺激性气体放出和白色沉淀产生,加入淡黄色固体的物质的量(横坐标)与析出的沉淀和产生气体的物质的量(纵坐标)的关系如图所示.该淡黄色物质做焰色反应实验显黄色.可知溶液中含有的离子是
某溶液中只可能含有Fe2+、Mg2+、Cu2+、NH4+、Al3+、Cl-、OH-、CO32-.当加入一种淡黄色固体并加热时,有刺激性气体放出和白色沉淀产生,加入淡黄色固体的物质的量(横坐标)与析出的沉淀和产生气体的物质的量(纵坐标)的关系如图所示.该淡黄色物质做焰色反应实验显黄色.可知溶液中含有的离子是