题目内容
下列叙述的理由与结论因果关系正确的是( )
| 选项 | 理由 | 结论 |
| A | 与盐酸反应时,相同物质的量的原子失去电子的数目:Al>Na | 还原性:Al>Na |
| B | 室温时,相同物质的量浓度溶液的pH:AlCl3<MgCl2 | 碱性:Mg(OH)2>Al(OH)3 |
| C | 相同数目的分子可电离的H+数:H2SO4>HClO4 | 酸性:H2SO4>HClO4 |
| D | 用饱和NaHCO3溶液可以除去CO2 中含有的少量SO2 | 非金属性:S>C |
| A、A | B、B | C、C | D、D |
考点:同一周期内元素性质的递变规律与原子结构的关系
专题:
分析:A、还原性强弱与失电子的多少无关,与失电子的难易程度有关;
B、室温时,相同物质的量浓度的强酸弱碱盐溶液pH越小水解程度越大,金属阳离子对应的碱越弱;
C、非羟基氧越多,酸性越强;
D、亚硫酸的酸性大于碳酸的酸性,则二氧化硫与碳酸氢钠溶液反应;
B、室温时,相同物质的量浓度的强酸弱碱盐溶液pH越小水解程度越大,金属阳离子对应的碱越弱;
C、非羟基氧越多,酸性越强;
D、亚硫酸的酸性大于碳酸的酸性,则二氧化硫与碳酸氢钠溶液反应;
解答:
解:A、还原性强弱与失电子的多少无关,与失电子的难易程度有关,不相符,故A错误;
B、室温时,相同物质的量浓度的强酸弱碱盐溶液pH越小水解程度越大,金属阳离子对应的碱越弱,因为相同物质的量浓度溶液的pH:AlCl3<MgCl2,所以碱性:Mg(OH)2>Al(OH)3,故B正确;
C、非羟基氧越多,HClO4中3个非羟基氧,而硫酸中2个非羟基氧,所以HClO4酸性越强,不相符,故C错误;
D、亚硫酸的酸性大于碳酸的酸性,则二氧化硫与碳酸氢钠溶液反应,而非S非金属性>C非金属性,故D错误;
故选B.
B、室温时,相同物质的量浓度的强酸弱碱盐溶液pH越小水解程度越大,金属阳离子对应的碱越弱,因为相同物质的量浓度溶液的pH:AlCl3<MgCl2,所以碱性:Mg(OH)2>Al(OH)3,故B正确;
C、非羟基氧越多,HClO4中3个非羟基氧,而硫酸中2个非羟基氧,所以HClO4酸性越强,不相符,故C错误;
D、亚硫酸的酸性大于碳酸的酸性,则二氧化硫与碳酸氢钠溶液反应,而非S非金属性>C非金属性,故D错误;
故选B.
点评:本题考查物质性质,熟练掌握常见元素化合物知识,注意还原性强弱与失电子的多少无关,与失电子的难易程度有关,题目难度不大.

练习册系列答案
 浙江之星课时优化作业系列答案
浙江之星课时优化作业系列答案 激活思维优加课堂系列答案
激活思维优加课堂系列答案
相关题目
下列各组物质熔点高低的比较准确的是( )
| A、晶体硅>金刚石>碳化硅 |
| B、CsCl>KCl>NaCl |
| C、SiO2>CO2>He |
| D、I2>Br2>Fe |
常温下,下列溶液中一定能大量共存的离子组是( )
| A、使pH试纸呈红色的溶液:Na+、[Al(OH)4]-、SO42-、Cl- |
| B、澄清透明溶液:Cr2O72-、SO42-、K+、NO3- |
| C、pH=0的溶液:Na+、C2O42-、MnO4-、SO42- |
| D、水电离产生的c(H+)=1×10-12mol?L-1的溶液:HCO3-、NH4+、C1-、Ca2+ |
欲除去CaCl2溶液中混有的少量FeCl3,最后加入的试剂为( )
| A、氢氧化钠 | B、氧化钙 |
| C、碳酸钠 | D、碳酸钙 |
有下列试剂 ①KSCN ②淀粉-碘化钾溶液 ③Fe ④Cu ⑤H2S ⑥NH3?H2O ⑦Na2CO3溶液,和三氯化铁溶液反应时,使Fe 3+表现出氧化性的试剂有( )
| A、①⑥⑦ | B、②③④⑤ |
| C、④⑤⑥⑦ | D、全部 |
 图中 A、B、C、D、E均为有机化合物.已知:C能跟NaHCO3发生反应;C和D的相对分子质量相等,且E为无支链的化合物.根据图回答问题:
图中 A、B、C、D、E均为有机化合物.已知:C能跟NaHCO3发生反应;C和D的相对分子质量相等,且E为无支链的化合物.根据图回答问题:
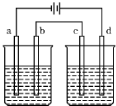 按图电解实验装置(都是惰性电极),若通直流电一段时间后,左池中溶液的pH上升,右池中溶液的pH下降,不仅a,b两电极放电离子的物质的量相等,且b,c两电极放电离子的物质的量也相等,则电解液应选用下表中的( )
按图电解实验装置(都是惰性电极),若通直流电一段时间后,左池中溶液的pH上升,右池中溶液的pH下降,不仅a,b两电极放电离子的物质的量相等,且b,c两电极放电离子的物质的量也相等,则电解液应选用下表中的( )