题目内容
6.下列有关化学实验的叙述正确的是( )| A. | NaOH 溶液保存在带玻璃塞的试剂瓶中 | |
| B. | 配制FeCl2 溶液时,通常向溶液中加入少量Fe 粉 | |
| C. | Cl2 和SO2 都有漂白作用,将Cl2 和SO2 等体积混合后可使品红溶液更快褪色 | |
| D. | 配制物质的量浓度的溶液,定容时仰视刻度线会使所配制的溶液浓度偏高 |
分析 A、氢氧化钠能够与玻璃中的二氧化硅反应,不能保存中玻璃塞中的试剂瓶中;
B、FeCl2溶液中Fe2+极不稳定,极易被强氧化剂氧化生成Fe3+,且FeCl2水解生成Fe(OH)2而使溶液变浑浊,据此分析解答;
C、将等物质的量的SO2和Cl2反应生成盐酸和硫酸;
D、配制溶液时仰视容量瓶刻度线定容,是刻度定液面,加入的水高出刻度线.
解答 解:A、氢氧化钠溶液能够与玻璃塞中的二氧化硅反应,不能保存中玻璃塞的试剂瓶中,应该使用橡胶塞,故A错误;
B、FeCl2溶液中Fe2+极不稳定,极易被强氧化剂氧化生成Fe3+,且FeCl2水解生成Fe(OH)2而使溶液变浑浊,为防止Fe2+被氧化、FeCl2水解,且不引进杂质,应该向溶液中加入少量Fe和稀盐酸,故B正确;
C、等物质的量的SO2和Cl2混合后的气体溶解于适量的蒸馏水中,发生反应:SO2+Cl2+2H2O=2HCl+H2SO4,生成盐酸和硫酸都不具有漂白性,所以不能使品红溶液褪色,故C错误;
D、配制溶液时仰视容量瓶刻度线定容,是刻度定液面,加入的水高出刻度线,会使溶液浓度偏低,故D错误;
故选B.
点评 本题考查了二氧化硅的性质、亚铁溶液的配制,二氧化硫和氯水的漂白性的应用,配制溶液误差分析方法,题目难度中等.

练习册系列答案
相关题目
16.化学与生活密切相关.下列生活中常见物质的俗名与化学式相对应的是( )
| A. | 小苏打--Na2CO3 | B. | 熟石灰--Ca (OH)2 | C. | 漂白粉-Ca(ClO)2 | D. | 氯水--Cl2 |
17.以下物质间的每步转化都是通过一步反应能实现的是( )
| A. | Al→Al2O3→Al(OH)3→NaAlO2 | B. | Fe→FeO→Fe(OH)2→Fe(OH)3 | ||
| C. | S→SO3→H2SO4→MgSO4 | D. | N2→NO→NO2→HNO3 |
14.下列离子方程式书写正确的是( )
| A. | 铝粉投入到NaOH溶液中:2Al+2OH-═2AlO2-+H2↑ | |
| B. | AlCl3溶液中加入足量的氨水:Al3++3OH-═Al(OH)3↓ | |
| C. | 三氯化铁溶液中加入铁粉:Fe3++Fe═2Fe2+ | |
| D. | 向Al(OH)3沉淀中滴加盐酸:Al(OH)3+3H+═Al3++3H2O |
11.下列关于Na2CO3与NaHCO3固体性质比较中,正确的是( )
| A. | 常温时,等浓度的溶液的碱性:Na2CO3<NaHCO3 | |
| B. | 二者均可与澄清石灰水反应生成白色沉淀 | |
| C. | 与同浓度的盐酸反应放出气体的速率快慢:Na2CO3>NaHCO3 | |
| D. | 等质量的Na2CO3和NaHCO3分别与过量的盐酸反应,产物CO2的质量相等 |
18.下列各物质相互反应后,再向得到的溶液中滴入NaOH溶液,能直接生成红褐色沉淀的是( )
| A. | 氯水和氯化亚铁溶液 | B. | 铁屑和氯化铜溶液 | ||
| C. | 铁屑和过量稀硫酸 | D. | 过量铁屑和氯化铁溶液 |
15.大多数有机物分子中的碳原子与其他原子结合方式是( )
| A. | 形成4对共用电子对 | B. | 通过非极性键 | ||
| C. | 通过2个共价键 | D. | 通过离子键和共价键 |
16.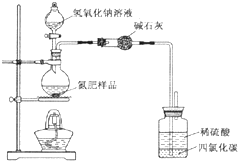 某氮肥硫酸铵中混有硫酸氢铵.为测定该氮肥的含氮量,一化学研究性学习小组取一定量氮肥样品,研磨使其混合均匀,备用.已知:
某氮肥硫酸铵中混有硫酸氢铵.为测定该氮肥的含氮量,一化学研究性学习小组取一定量氮肥样品,研磨使其混合均匀,备用.已知:
氢氧化钠少量时2NH4HSO4+2NaOH═(NH4)2SO4+Na2SO4+2H2O
氢氧化钠过量时NH4HSO4+2NaOH═Na2SO4+NH3↑+2H2O
(1)同学们设计的实验装置图如图,请回答相关问题.
①装置中碱石灰的作用是吸收氨气中的水蒸气.
②广口瓶内四氯化碳的作用是防止倒吸.
③指导老师指出,用该装置进行实验,即使氢氧化钠足量且实验过程中无氨气外逸,测得的样品含氮量仍将偏低,其原因可能是残留在反应装置中的氨气未被稀硫酸吸收.
(2)同学们改进实验装置后(改进装置图略),进行如下实验.
称取不同质量的上述样品分别与40.00mL相同浓度的氢氧化钠溶液混合,完全溶解后,加热充分反应(此温度下铵盐不分解),并使生成的氨气全部被稀硫酸吸收,测得氨气的质量.部分实验数据如下:
请计算(计算结果保留两位小数):
①样品中氮元素的质量分数是19.87%.
②所用氢氧化钠溶液的物质的量浓度为3.25 mol/L.
 某氮肥硫酸铵中混有硫酸氢铵.为测定该氮肥的含氮量,一化学研究性学习小组取一定量氮肥样品,研磨使其混合均匀,备用.已知:
某氮肥硫酸铵中混有硫酸氢铵.为测定该氮肥的含氮量,一化学研究性学习小组取一定量氮肥样品,研磨使其混合均匀,备用.已知:氢氧化钠少量时2NH4HSO4+2NaOH═(NH4)2SO4+Na2SO4+2H2O
氢氧化钠过量时NH4HSO4+2NaOH═Na2SO4+NH3↑+2H2O
(1)同学们设计的实验装置图如图,请回答相关问题.
①装置中碱石灰的作用是吸收氨气中的水蒸气.
②广口瓶内四氯化碳的作用是防止倒吸.
③指导老师指出,用该装置进行实验,即使氢氧化钠足量且实验过程中无氨气外逸,测得的样品含氮量仍将偏低,其原因可能是残留在反应装置中的氨气未被稀硫酸吸收.
(2)同学们改进实验装置后(改进装置图略),进行如下实验.
称取不同质量的上述样品分别与40.00mL相同浓度的氢氧化钠溶液混合,完全溶解后,加热充分反应(此温度下铵盐不分解),并使生成的氨气全部被稀硫酸吸收,测得氨气的质量.部分实验数据如下:
| 氢氧化钠溶液体积/mL | 40.00mL | ||
样品质量/g | 7.750 | 15.50 | 23.25 |
氨气质量/g | 1.870 | 1.870 | 1.700 |
①样品中氮元素的质量分数是19.87%.
②所用氢氧化钠溶液的物质的量浓度为3.25 mol/L.
 化学是一门以实验为基础的自然科学.
化学是一门以实验为基础的自然科学.