题目内容
11.将32.64g Cu与140mL一定浓度的HNO3反应,Cu完全溶解,产生的NO和NO2混合气体在标准状况下的体积为11.2L.请回答:①NO的体积约为(保留小数点后一位)5.8L.
②待产生的气体全部释放后,向溶液中加入V mL a mol/L的NaOH溶液,恰好使溶液中的Cu2+全部转化为沉淀,则原HNO3的物质的量浓度为(列表达式即可,不用化简)$\frac{(0.5+Va×1{0}^{-3})}{0.14}$mol/L.
分析 n(Cu)=$\frac{32.64g}{64g/mol}$=0.51mol,n(气体)=$\frac{11.2L}{22.4L/mol}$=0.5mol,
①设的NO和NO2的物质的量分别为x、y,则
$\left\{\begin{array}{l}{x+y=0.5}\\{0.51×2=3x+y}\end{array}\right.$,
再结合V=nVm计算;
②原HNO3的物质的量为0.5mol+V×10-3L×amol/L,结合c=$\frac{n}{V}$计算.
解答 解:n(Cu)=$\frac{32.64g}{64g/mol}$=0.51mol,n(气体)=$\frac{11.2L}{22.4L/mol}$=0.5mol,
①设的NO和NO2的物质的量分别为x、y,则
$\left\{\begin{array}{l}{x+y=0.5}\\{0.51×2=3x+y}\end{array}\right.$,
解得x=0.26mol,
V(NO)=nVm=0.26mol×22.4L/mol=5.824L≈5.8L,
故答案为:5.8L;
②待产生的气体全部释放后,向溶液中加入V mL a mol/L的NaOH溶液,恰好使溶液中的Cu2+全部转化为沉淀,
则原HNO3的物质的量为0.5mol+V×10-3L×amol/L=(0.5+Va×10-3)mol,
则原HNO3的物质的量浓度为$\frac{(0.5+Va×1{0}^{-3})}{0.14}$mol/L,
故答案为:$\frac{(0.5+Va×1{0}^{-3})}{0.14}$mol/L.
点评 本题考查氧化还原反应的计算,为高频考点,把握原子、电子守恒及物质的量的相关计算为解答的关键,侧重分析与计算能力的考查,注意守恒法应用,题目难度不大.

 小学数学口算题卡脱口而出系列答案
小学数学口算题卡脱口而出系列答案 优秀生应用题卡口算天天练系列答案
优秀生应用题卡口算天天练系列答案 浙江之星课时优化作业系列答案
浙江之星课时优化作业系列答案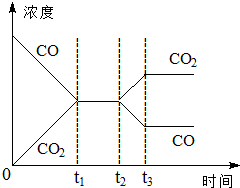 在一个恒容反应器中发生反应:CO(g)+H2O(g)?H2(g)+CO2(g),该反应的平衡常数随温度的变化如表:
在一个恒容反应器中发生反应:CO(g)+H2O(g)?H2(g)+CO2(g),该反应的平衡常数随温度的变化如表:| 温度/℃ | 400 | 500 | 830 |
| 平衡常数K | 10 | 9 | 1 |
(2)830℃时,向反应器中投入1mol CO(g)、2mol H2O(g)、xmol H2(g)和0.5mol CO2(g)发生上述反应,要使反应开始时向逆反应方向进行,x的取值范围是x>4.
(3)若反应器绝热,判断该反应达到平衡状态的标志是①④(填序号)
①体系的压强不再发生变化
②混合气体的密度不变
③混合气体的平均相对分子质量不变
④各组分的物质的量浓度不再改变
⑤消耗1mol H2O(g)的同时,生成1mol CO2(g)
(4)如图表示该反应在t1时刻达到平衡,在t2时刻因改变某个条件浓度变化的情况,图中t2时刻发生改变的条件可能是降低温度,或增加水蒸汽的量,或减少氢气的量(写出两种).
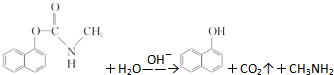
有关说法正确的是( )
| A. | 西维因分子式为C12H10NO2 | |
| B. | 1 mol西维因最多能与6 mol氢气发生加成反应 | |
| C. | 反应后经酸化,可用FeCl3溶液检验是否发生水解 | |
| D. | 西维因分子中至少有21个原子共平面 |
| A. | 酒精 | B. | 汽油 | C. | 柴油 | D. | 液化石油气 |

| A. | ④和⑧ | B. | ①、②和③ | C. | ⑤、⑦和⑧ | D. | ④、⑥和⑧ |
| A. | 石英和浓盐酸混合 | B. | 水玻璃中通入二氧化碳 | ||
| C. | 硅藻土和浓烧碱共热 | D. | 二氧化硅和氢氟酸混合 |
| A. | 标准状况下,22.4 L CCl4中含有氯原子数目为4 NA | |
| B. | 7 g C2H4中含有的氢原子数目为NA | |
| C. | 1 mol Al 失去电子变成 Al3+后质子数目为10 NA | |
| D. | 1 L 0.5 mol/L Na2CO3溶液中含有的CO32-数目为0.5 NA |
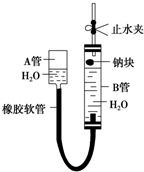 如图是某化学学习小组用来探究钠与水反应的实验装置.该装置可以集反应、收集、检验气体于一体.图中钠块是用大头针叉住的.请填空:
如图是某化学学习小组用来探究钠与水反应的实验装置.该装置可以集反应、收集、检验气体于一体.图中钠块是用大头针叉住的.请填空: