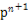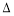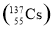ћвƒњƒЏ»Ё
2013ƒк≥х,ќнц≤ћм∆шґаіќЋЅ≈∞ќ“єъ÷–ґЂ≤њµЎ«ш°£∆д÷–,∆ы≥µќ≤∆шЇЌ»Љ√Їќ≤∆ш «‘м≥…њ’∆шќџ»Њµƒ‘≠“т÷Ѓ“ї°£
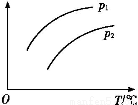
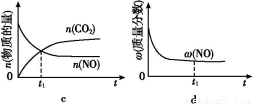
(1)∆ы≥µќ≤∆шЊїїѓµƒ÷ч“™‘≠јнќ™:2NO(g)+2CO(g)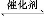 2CO2(g)+N2(g)°£‘Џ√№±’»Ё∆ч÷–ЈҐ…ъЄ√Јі”¶ ±,c(CO2)Ћжќ¬ґ»(T)°ҐіяїѓЉЅµƒ±н√жїэ(S)ЇЌ ±Љд(t)µƒ±дїѓ«ъѕя,»зЌЉЋщ Њ°£
2CO2(g)+N2(g)°£‘Џ√№±’»Ё∆ч÷–ЈҐ…ъЄ√Јі”¶ ±,c(CO2)Ћжќ¬ґ»(T)°ҐіяїѓЉЅµƒ±н√жїэ(S)ЇЌ ±Љд(t)µƒ±дїѓ«ъѕя,»зЌЉЋщ Њ°£
ЊЁіЋ≈–ґѕ:
ҐўЄ√Јі”¶µƒ¶§H°°°°0(ћо°∞>°±їт°∞<°±)°£
ҐЏ‘ЏT2ќ¬ґ»ѕ¬,0°Ђ2 sƒЏµƒ∆љЊщЈі”¶Ћў¬ v(N2)=°°°°°°°°°£
Ґџµ±єћћеіяїѓЉЅµƒ÷ Ѕњ“їґ® ±,‘ціу∆д±н√жїэњ…ћбЄяїѓ—ІЈі”¶Ћў¬ °£»фіяїѓЉЅµƒ±н√жїэS1>S2,‘Џ…ѕЌЉ÷–ї≠≥цc(CO2)‘ЏT1°ҐS2ћхЉюѕ¬іпµљ∆љЇвєэ≥ћ÷–µƒ±дїѓ«ъѕя°£
Ґ№»фЄ√Јі”¶‘ЏЊш»»°ҐЇг»Ёµƒ√№±’ћеѕµ÷–љш––,ѕ¬Ѕ– Њ“вЌЉ’э»Ј«“ƒ№Ћµ√чЈі”¶‘Џљш––µљt1 ±њћіпµљ∆љЇв„іћђµƒ «°°°°°°°°(ћоіъЇ≈)°£
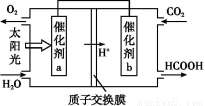
(2)÷±љ”≈≈Ј≈√Ї»Љ…’≤ъ…ъµƒ—ћ∆шїб“э∆р—ѕ÷ЎµƒїЈЊ≥ќ ћв°£
Ґў√Ї»Љ…’≤ъ…ъµƒ—ћ∆шЇђµ™µƒ—хїѓќп,”√CH4іяїѓїє‘≠NOxњ…“‘ѕы≥эµ™—хїѓќпµƒќџ»Њ°£
јэ»з:
CH4(g)+2NO2(g) N2(g)+CO2(g)+2H2O(g) ¶§H1=-867 kJ/mol
N2(g)+CO2(g)+2H2O(g) ¶§H1=-867 kJ/mol
2NO2(g) N2O4(g) ¶§H2=-56.9 kJ/mol
N2O4(g) ¶§H2=-56.9 kJ/mol
–і≥цCH4(g)іяїѓїє‘≠N2O4(g)…ъ≥…N2(g)ЇЌH2O(g)µƒ»»їѓ—ІЈљ≥ћ љ:°° °£
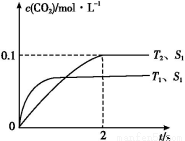
ҐЏљЂ»Љ√Ї≤ъ…ъµƒґю—хїѓћЉїЎ ’јы”√,њ…іпµљµЌћЉ≈≈Ј≈µƒƒњµƒ°£»зЌЉ «Ќ®єэ»Ћє§євЇѕ„ч”√,“‘CO2ЇЌH2Oќ™‘≠Ѕѕ÷∆±ЄHCOOHЇЌO2µƒ‘≠јн Њ“вЌЉ°£іяїѓЉЅb±н√жЈҐ…ъµƒµзЉЂЈі”¶ љќ™°° °£
(1)Ґў<°°ҐЏ0.025 mol/(L°§s)
Ґџ

Ґ№bd
(2)ҐўCH4(g)+N2O4(g) N2(g)+CO2(g)+2H2O(g) ¶§H=-810.1 kJ/mol
N2(g)+CO2(g)+2H2O(g) ¶§H=-810.1 kJ/mol
ҐЏCO2+2H++2e- HCOOH
HCOOH
°Њљвќц°њ(1)Ґџќ¬ґ»‘љЄяЈі”¶Ћў¬ ‘љіу,іяїѓЉЅљ”і•√жїэ‘љіуЈі”¶Ћў¬ ‘љіу,Јі”¶µљіп∆љЇвµƒ ±Љд‘љґћ°£

Ґ№a.Јі”¶іпµљ∆љЇв„іћђ ±,Єчќп÷ µƒЈі”¶Ћў¬ ≤ї‘ў±дїѓ,є інќу°£b.Є√Јі”¶‘ЏЊш»»°ҐЇг»Ёµƒ√№±’ћеѕµ÷–љш––,ѕаµ±”Џ…эЄяќ¬ґ»,µ±ќ¬ґ»≤ї±д ±,їѓ—І∆љЇв≥£ э≤ї±д,є ’э»Ј°£c.ґю—хїѓћЉЇЌ“ї—хїѓµ™µƒќп÷ µƒЅњѕаµ» ±,Є√Јі”¶≤ї“їґ®іпµљ∆љЇв„іћђ,є інќу°£d.Јі”¶іпµљ∆љЇв„іћђ ±,Єчќп÷ µƒ÷ ЅњЈ÷ э≤ї‘ўЈҐ…ъ±дїѓ,є ’э»Ј°£
(2)ҐўљЂµЏ“їЄцЈљ≥ћ љЉхµЏґюЄцЈљ≥ћ љµ√:
CH4(g)+N2O4(g) N2(g)+CO2(g)+2H2O(g) ¶§H=-810.1 kJ/mol°£
N2(g)+CO2(g)+2H2O(g) ¶§H=-810.1 kJ/mol°£
ҐЏіяїѓЉЅb±н√ж…ѕґю—хїѓћЉµ√µз„”ЇЌ«вјл„”Јі”¶…ъ≥…Љ„Ћб,Ћщ“‘ЈҐ…ъµƒµзЉЂЈі”¶ љќ™:
CO2+2H++2e- HCOOH°£
HCOOH°£

ґћ÷№∆Џµƒќе÷÷‘™ЋЎA°ҐB°ҐC°ҐD°ҐE,‘≠„”–т э“јіќ‘ціу°£A°ҐB°ҐC»э÷÷‘™ЋЎµз„”≤г э÷ЃЇЌ «5°£A°ҐBЅљ‘™ЋЎ‘≠„”„оЌв≤гµз„” э÷ЃЇЌµ»”ЏC‘™ЋЎ‘≠„”„оЌв≤гµз„” э;B‘™ЋЎ‘≠„”„оЌвµз„”≤г…ѕµƒµз„” э «Ћьµƒµз„”≤г эµƒ2±ґ,A”лDњ…“‘–ќ≥…‘≠„”Єц э±»Ј÷±рќ™1°√1ЇЌ2°√1µƒЅљ÷÷“ЇћђїѓЇѕќп;Eµ•÷ ”√”ЏЊїїѓЋЃ÷ °£
«лїЎір:
(1)–і≥цD‘Џ‘™ЋЎ÷№∆Џ±н÷–µƒќї÷√°° ,
Eµƒ‘≠„”љбєє Њ“вЌЉ «°°°°°°°°°°°°°°°°°£
ѕ¬Ѕ–њ…“‘—й÷§C”лDЅљ‘™ЋЎ‘≠„”µ√µз„”ƒ№Ѕ¶«њ»хµƒ µ—й ¬ µ «°°°°°°°°(ћо–і±аЇ≈)°£
A.±»љѕ’вЅљ÷÷‘™ЋЎµƒ∆шћђ«вїѓќпµƒЈ–µг
B.±»љѕ÷ї”–’вЅљ÷÷‘™ЋЎЋщ–ќ≥…µƒїѓЇѕќп÷–µƒїѓЇѕЉџ
C.±»љѕ’вЅљ÷÷‘™ЋЎµƒ∆шћђ«вїѓќпµƒќ»ґ®–‘
D.±»љѕ’вЅљ÷÷‘™ЋЎµƒµ•÷ ”л«в∆шїѓЇѕµƒƒ—“„
(2)”…A°ҐBЅљ÷÷‘™ЋЎ„й≥…µƒ„оЉтµ•µƒїѓЇѕќп,–і≥ц∆дµз„” љ°°°°°°°°°£
(3)Њщ”…A°ҐB°ҐC°ҐDЋƒ÷÷‘™ЋЎ„й≥…µƒЉ„°Ґ““Ѕљ÷÷їѓЇѕќп,ґЉЉ»њ…“‘”л—ќЋбЈі”¶”÷њ…“‘”лNaOH»№“ЇЈі”¶,Љ„ќ™ќёїъ—ќ,∆дїѓ—І љќ™°°°°°°°°,““ќ™ћм»їЄяЈ÷„”їѓЇѕќпµƒЋЃљв≤ъќп,«“ «Ќђјаќп÷ ÷–ѕаґ‘Ј÷„”÷ Ѕњ„о–°µƒ,∆дљбєєЉт љќ™°°°°°°°°°°°°°°°°°°°°°°°£
(4)љЇћђі≈Ѕчће‘Џ“љ—І…ѕ”–÷Ў“™µƒ”√ЌЊ,ґшƒ…√„ЉґFe3O4 «і≈Ѕчће÷–µƒ÷Ў“™Ѕ£„”,∆д÷∆±Єєэ≥ћњ…Љтµ•±н Њ»зѕ¬:
ҐўљЂїѓЇѕќпCA3Ќ®»лµ»ќп÷ µƒЅњµƒFeSO4°ҐFe2(SO4)3µƒїмЇѕ»№“Ї÷–,…ъ≥…Ѕљ÷÷Љо,–і≥цЄ√Јі”¶єэ≥ћµƒ„№µƒјл„”Јљ≥ћ љ°° °£
ҐЏ…ѕ цЈі”¶…ъ≥…µƒЅљ÷÷ЉоЉћ–ш„ч”√,µ√µљFe3O4°£
(5)“—÷™ѕ¬±н эЊЁ:
ќп÷ | Fe(OH)2 | Fe(OH)3 |
Ksp/25 °ж | 2.0°Ѕ10-16 | 4.0°Ѕ10-36 |
»ф єїмЇѕ“Ї÷–FeSO4°ҐFe2(SO4)3µƒ≈®ґ»Њщќ™2.0 mol°§L-1,‘тїмЇѕ“Ї÷–c(OH-)≤їµ√іу”Џ°°°°°°°°mol°§L-1°£