题目内容
将117g NaCl溶于水配制成1L溶液,回答下列问题:
(1)该溶液中NaCl的物质的量浓度为多少?
(2)配制1mol?L-1的NaCl溶液500mL,需要该溶液的体积为多少?
(3)向(2)所配制的溶液中再通入一定量的HCl气体后,溶液中Cl-的物质的量浓度为3mol?L-1(假设溶液体积不变),则溶液中H+的物质的量浓度为多少?通入HCl气体的体积(标准状况下)为多少?
(1)该溶液中NaCl的物质的量浓度为多少?
(2)配制1mol?L-1的NaCl溶液500mL,需要该溶液的体积为多少?
(3)向(2)所配制的溶液中再通入一定量的HCl气体后,溶液中Cl-的物质的量浓度为3mol?L-1(假设溶液体积不变),则溶液中H+的物质的量浓度为多少?通入HCl气体的体积(标准状况下)为多少?
考点:物质的量浓度的相关计算
专题:物质的量浓度和溶解度专题
分析:(1)根据n=
计算氯化钠的物质的量,再根据c=
计算;
(2)根据稀释定律计算需要该氯化钠溶液的体积;
(3)溶液中溶质为NaCl、HCl,根据电荷守恒c(Na+)+c(H+)=c(Cl-),据此计算溶液在c(H+),而c(HCl)=c(H+),根据c=nV计算n(HCl),再根据V=nVm计算通入HCl的体积.
| m |
| M |
| n |
| V |
(2)根据稀释定律计算需要该氯化钠溶液的体积;
(3)溶液中溶质为NaCl、HCl,根据电荷守恒c(Na+)+c(H+)=c(Cl-),据此计算溶液在c(H+),而c(HCl)=c(H+),根据c=nV计算n(HCl),再根据V=nVm计算通入HCl的体积.
解答:
解:(1)117g NaCl的物质的量=
=2mol,溶于水配成1L溶液,所配溶液浓度=
=2mol/L,
答:该溶液中NaCl的物质的量浓度为2mol/L;
(2)设需要2mol/L NaCl溶液体积为V L,根据稀释定律,则:
2mol/L×V L=0.5L×1mol/L
解得V=0.25
答:需要2mol/L NaCl溶液体积为0.25 L;
(3)溶液中溶质为NaCl、HCl,根据电荷守恒c(Na+)+c(H+)=c(Cl-),溶液中c(Na+)=1mol/L,c(Cl-)=3mol/L,则c(H+)=3mol/L-1mol/L=2mol/L,而c(HCl)=c(H+)=2mol/L,故n(HCl)=0.5L×2mol/L=1mol,故通入HCl的体积=1mol×22.4L/mol=22.4L,
答:溶液中H+的物质的量浓度为2mol/L.通入HCl气体的体积(标准状况下)为22.4L.
| 117g |
| 58.5g/mol |
| 2mol |
| 1L |
答:该溶液中NaCl的物质的量浓度为2mol/L;
(2)设需要2mol/L NaCl溶液体积为V L,根据稀释定律,则:
2mol/L×V L=0.5L×1mol/L
解得V=0.25
答:需要2mol/L NaCl溶液体积为0.25 L;
(3)溶液中溶质为NaCl、HCl,根据电荷守恒c(Na+)+c(H+)=c(Cl-),溶液中c(Na+)=1mol/L,c(Cl-)=3mol/L,则c(H+)=3mol/L-1mol/L=2mol/L,而c(HCl)=c(H+)=2mol/L,故n(HCl)=0.5L×2mol/L=1mol,故通入HCl的体积=1mol×22.4L/mol=22.4L,
答:溶液中H+的物质的量浓度为2mol/L.通入HCl气体的体积(标准状况下)为22.4L.
点评:本题考查物质的量浓度有关计算,难度不大,注意(3)中电解质混合溶液中利用电荷守恒计算离子浓度.

练习册系列答案
相关题目
某合作学习小组讨论辨析以下说法:上述说法正确的是( )
①粗盐和酸雨都是混合物;
②冰和干冰既是纯净物又是化合物;
③CO2和Na2O都是电解质;
④Cl2是非电解质⑤明矾净水和胶体性质有关;
⑥豆浆和雾都是胶体.
①粗盐和酸雨都是混合物;
②冰和干冰既是纯净物又是化合物;
③CO2和Na2O都是电解质;
④Cl2是非电解质⑤明矾净水和胶体性质有关;
⑥豆浆和雾都是胶体.
| A、①②⑤⑥ | B、①②④⑤⑥ |
| C、①②③⑤⑥ | D、①②③④⑤ |
下列物质属于纯净物的是( )
| A、冰水混合物 | B、洁净的空气 |
| C、食醋 | D、清澈的海水 |
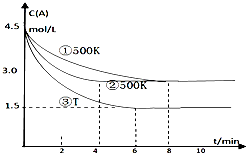 某反应2A(g)?2B(g)+C(g)(吸热反应)在三种不同条件下进行,B、C的起始浓度为0,A的浓度(mol/L)随反应时间(min)的变化情况如图所示.
某反应2A(g)?2B(g)+C(g)(吸热反应)在三种不同条件下进行,B、C的起始浓度为0,A的浓度(mol/L)随反应时间(min)的变化情况如图所示.
