题目内容
11.下列各组物质中,都是强电解质的是( )| A. | HBr、Cu(OH)2、BaSO4 | B. | NaOH、Ca(OH)2、NH3•H2O | ||
| C. | HClO、NaF、Ba(OH)2 | D. | NH4Cl、CH3COONa、Na2S |
分析 电解质按照在水溶液或者熔融状态下电离的程度分为强电解质和弱电解质;
强电解质是指在水溶液中或熔融状态下能完全电离的化合物,包含强酸、强碱和大多数盐;
弱电解质是指在水溶液里部分电离的电解质,包括弱酸、弱碱、水与少数盐,据此解答.
解答 解:A、Cu(OH)2为难溶性弱碱,属于弱电解质,故A错误;
B、NH3•H2O为弱碱,属于弱电解质,故B错误;
C、HClO为弱酸,属于弱电解质,故C错误;
D、NH4Cl、CH3COONa、Na2S均为盐,属于强电解质,故D正确,
故选D.
点评 本题考查了强电解质与弱电解质的区别,题目难度不大,注意明确强弱电解质的本质区别是电离的程度.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
6.表是元素周期表的一部分,回答下列有关问题:
(1)写出下列元素符号:①N;⑥Si.
(2)画出⑤原子的结构示意图: .
.
③和⑧元素形成的化合物中含离子键键.(写化学键类型)
(3)在①--⑨的元素中,金属性最强的元素是Na,非金属性最强的元素是F,最不活泼的元素是Ar.(均用元素符号表示)
(4)⑧的最高价氧化物对应的水化物化学式是HClO4
(5)元素⑦与元素⑧相比,非金属性较强的是Cl>S(用元素符号表示),用一化学反应方程式表达这一事实Na2S+Cl2=S↓+2NaCl.
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | Ⅷ |
| 2 | ① | ② | ||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ |
(2)画出⑤原子的结构示意图:
 .
.③和⑧元素形成的化合物中含离子键键.(写化学键类型)
(3)在①--⑨的元素中,金属性最强的元素是Na,非金属性最强的元素是F,最不活泼的元素是Ar.(均用元素符号表示)
(4)⑧的最高价氧化物对应的水化物化学式是HClO4
(5)元素⑦与元素⑧相比,非金属性较强的是Cl>S(用元素符号表示),用一化学反应方程式表达这一事实Na2S+Cl2=S↓+2NaCl.
16.常温下,以下溶液中c(H+)最小的是( )
| A. | pH=0的某溶液 | B. | 0.1 mol•L-1 NaOH 溶液 | ||
| C. | 0.1mol•L-1 HCl 溶液 | D. | 0.1 mol•L-1的 NaCl 溶液 |
3.下列物质在一定条件下可与甲烷发生反应的是( )
| A. | 氯气 | B. | 溴水 | ||
| C. | 氢氧化钠溶液 | D. | 酸性高锰酸钾溶液 |
20.下列对一些实验事实的理论解释正确的是( )
| 选项 | 实验事实 | 理论解释 |
| A | 氮原子的第一电离能大于氧原子 | 氮原子2p能级半充满 |
| B | CO2为直线形分子 | CO2分子中C-O是极性键 |
| C | 金刚石的熔点低于石墨 | 金刚石是分子晶体,石墨是原子晶体 |
| D | HF的沸点高于HCl | HF的相对分子质量小于HCl |
| A. | A | B. | B | C. | C | D. | D |
1.下列关于铵盐叙述合理组合的是( )
(1)都是晶体
(2)都易溶于水
(3)加热都有氨气生成
(4)在溶液中和碱加热反应能放出氨气
(5)固体时和碱混合加热也能产生氨气.
(1)都是晶体
(2)都易溶于水
(3)加热都有氨气生成
(4)在溶液中和碱加热反应能放出氨气
(5)固体时和碱混合加热也能产生氨气.
| A. | (1)(2)(3)(5) | B. | (1)(2)(4)(5) | C. | (2)(4)(5) | D. | 都合理 |
 .
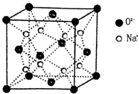
.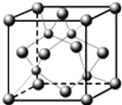 A、B、C、D都是元素周期表中的短周期元素,它们的核电荷数依次增大.第2周期元素A原子的核外成对电子数是未成对电子数的2倍,B原子的最外层p轨道的电子为半满结构,C是地壳中含量最多的元素,D原子的S电子与P电子数相等,E是第四周期元素,其原子核外最外层电子数与氢原子相同,其余各层电子均充满.请用对应的元素符号或化学式回答下列问题:
A、B、C、D都是元素周期表中的短周期元素,它们的核电荷数依次增大.第2周期元素A原子的核外成对电子数是未成对电子数的2倍,B原子的最外层p轨道的电子为半满结构,C是地壳中含量最多的元素,D原子的S电子与P电子数相等,E是第四周期元素,其原子核外最外层电子数与氢原子相同,其余各层电子均充满.请用对应的元素符号或化学式回答下列问题:
 (1)过渡金属元素铁能形成多种配合物,如:[Fe(H2NCONH2)6](NO3)3[三硝酸六尿素合铁(Ⅲ)和Fe(CO)x等.
(1)过渡金属元素铁能形成多种配合物,如:[Fe(H2NCONH2)6](NO3)3[三硝酸六尿素合铁(Ⅲ)和Fe(CO)x等.