题目内容
4.下列离子方程式中正确的是( )| A. | 少量的NaHCO3逐滴加入Ba(OH)2溶液中:HCO3-+Ba2++OH-═BaCO3↓+H2O | |
| B. | NaHSO4溶液与Ba(OH)2溶液反应至中性:H++SO42-+Ba2++OH-═BaSO4↓+H2O | |
| C. | 苯酚钠溶液中通入少量的CO2:2C6H5O-+CO2+H2O→CO32-+2C6H5OH | |
| D. | 向100 mL 3mol•L-1FeBr2溶液中通入标准状况下 3.36 LCl2:2Fe2++4Br-+3Cl2═2Fe3++2Br2+6Cl- |
分析 A.反应生成碳酸钡、水、NaOH;
B.反应生成硫酸钡、硫酸钠和水;
C.反应生成苯酚和碳酸氢钠;
D.n(FeBr2)=0.1L×3mol/L=0.3mol,n(Cl2)=$\frac{3.36L}{22.4L/mol}$=0.15mol,由还原性亚铁离子大于溴离子及电子守恒可知,只有亚铁离子被氧化.
解答 解:A.少量的NaHCO3逐滴加入Ba(OH)2溶液中的离子反应为HCO3-+Ba2++OH-═BaCO3↓+H2O,故A正确;
B.NaHSO4溶液与Ba(OH)2溶液反应至中性的离子反应为2H++SO42-+Ba2++2OH-═BaSO4↓+2H2O,故B错误;
C.苯酚钠溶液中通入少量的CO2的离子反应为C6H5O-+CO2+H2O→HCO3-+C6H5OH,故C错误;
D.向100 mL 3mol•L-1FeBr2溶液中通入标准状况下 3.36 LCl2的离子反应为2Fe2++Cl2═2Fe3++2Cl-,故D错误;
故选A.
点评 本题考查离子反应方程式的书写,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重分析与应用能力的考查,注意氧化还原及与量有关的离子反应,题目难度不大.

练习册系列答案
 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案 教育世家状元卷系列答案
教育世家状元卷系列答案 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案 单元加期末复习先锋大考卷系列答案
单元加期末复习先锋大考卷系列答案
相关题目
15.分子式为C5H11Br的同分异构体有( )
| A. | 8种 | B. | 7种 | C. | 6种 | D. | 5种 |
12.12C原子的质量是a g,某氯原子的质量是b g,用NA表示阿伏加德罗常数的值,下列说法中错误的是 ①该氯原子的相对原子质量为$\frac{12a}{b}$ ②m g该氯原子的物质的量为m/(bNA)mol ③该氯原子的摩尔质量是aNA g ④b g该氯原子所含的电子数为17mol( )
| A. | ①③ | B. | ②④ | C. | ①② | D. | ①③④ |
16.下列说法正确的是( )
| A. | 用苯萃取溴水中的溴时,将溴的苯溶液从分液漏斗下口倒出 | |
| B. | 使用容量瓶的第一步操作是先将容量瓶用蒸馏水洗涤后烘干 | |
| C. | 用10 mL量筒量取9.2 mL NaCl溶液 | |
| D. | 检验某溶液是否含有SO42-时,应取少量该溶液,依次加入BaCl2溶液和稀盐酸 |
13.随着人们生活节奏的加快,方便的小包装食品已被广泛接受.为了防止中秋月饼等富脂食品氧化变质,延长食品的保质期,在包装袋中常加入抗氧化物质,下列不属于抗氧化物质的是( )
| A. | 硫酸亚铁 | B. | 还原铁粉 | C. | 亚硫酸钠 | D. | 生石灰 |
3.用NA表示阿伏加德罗常数的值.下列叙述正确的是( )
| A. | 标准状况下,22.4 L HF含有的分子数为 NA | |
| B. | 28 g N2和N4组成的混合气体中含有的原子数为2 NA | |
| C. | 1 mol•L-1A1Cl3溶液中含有的Cl-数目为3 NA | |
| D. | 5.6 gFe在0.1moCl2中充分燃烧,转移的电子数目为0.3NA |
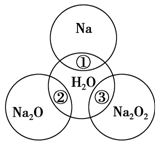 如图所示,两圆圈相交的部分表示圆圈内的物质相互发生的反应.已知钠及其氧化物的物质的量均为0.1mol,水的质量为100g,忽略溶液中溶剂的变化.完成下列题目.
如图所示,两圆圈相交的部分表示圆圈内的物质相互发生的反应.已知钠及其氧化物的物质的量均为0.1mol,水的质量为100g,忽略溶液中溶剂的变化.完成下列题目.