题目内容
16.下列物质性质与应用对应关系正确的是( )| A. | 氨气具有还原性,可用于检查HCl泄漏 | |
| B. | 浓硫酸具有脱水性,可用于干燥CO2 | |
| C. | 氧化铝具有高熔点,可用于生产耐火砖 | |
| D. | Cl2有酸性,可与烧碱反应制备含氯消毒剂 |
分析 A.氨气和HCl反应产生白烟,该反应属于化合反应,没有电子转移,不属于氧化还原反应;
B.浓硫酸做干燥剂是因为其具有吸水性;
C.耐火材料应具有较高的熔沸点;
D.氯气与烧碱或石灰乳反应体现了氯气的氧化性和还原性.
解答 解:A.氨气和HCl反应产生白烟,该反应属于化合反应,没有电子转移,不属于氧化还原反应,所以氨气不体现还原性,故A错误;
B.浓硫酸具有吸水性,可用于干燥CO2,故B错误;
C.氧化铝的熔点很高,一般条件下不熔融,所以氧化铝能作耐火砖,故C正确;
D.氯气与烧碱或石灰乳反应体现了氯气的氧化性和还原性,不是酸性,故D错误;
故选:C.
点评 本题考查了物质的用途,性质决定用途,熟悉氨气、浓硫酸、氧化铝、氯气的性质是解题关键,注意浓硫酸吸水性与脱水性的区别,题目难度不大.

练习册系列答案
 金钥匙试卷系列答案
金钥匙试卷系列答案
相关题目
17.下列说法不正确的是( )
| A. | 浓硝酸保存在带有玻璃塞的棕色试剂瓶中 | |
| B. | 已经完成定容的500mL 1.0mol•L-1的NaOH溶液,某同学不慎将容量瓶中溶液洒出部分,继续加水至溶液凹液面与刻线相切 | |
| C. | 用托盘天平称量出12.50g的NaCl固体 | |
| D. | 物质溶于水的过程中,一般有放热或吸热现象,因此溶解的操作不能在量筒中进行 |
7.下列各组离子在溶液中能够大量共存的是( )
| A. | K+、Cl-、NO${\;}_{3}^{-}$、Ag+ | B. | H+、HCO${\;}_{3}^{-}$、Na+、Cl- | ||
| C. | Na+、OH-、Ca2+、CO${\;}_{3}^{2-}$ | D. | Mg2+、Cl-、H+、SO${\;}_{4}^{2-}$ |
4.下列说法正确的是( )
| A. | 反应CaCO3(s)═CaO(s)+CO2(g)在常温下不能自发进行,则该反应的△H<0 | |
| B. | 0.lmol•L一1CH3COOH溶液加水稀释后,溶液中$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$的值减小 | |
| C. | 铅蓄电池在放电过程中,负极质量增加,正极质量减少 | |
| D. | 锅炉中沉积的CaSO4和BaSO4都可用饱和Na2CO3溶液浸泡,再将不溶物用稀盐酸溶解除去 |
11.如图所示,将铁棒和石墨棒插入1L 1mol•L-1食盐水中.下列说法正确的是( )
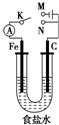

| A. | 若电键K与N连接,铁被保护不会腐蚀 | |
| B. | 若电键K与M连接,将石墨棒换成铜棒,可实现铁棒上镀铜 | |
| C. | 若电键K与N连接,正极反应式是 4OH--4e-═2H2O+O2↑ | |
| D. | 若电键K与M连接,当两极共产生22.4L(标准状况)气体时,生成了1mol NaOH |
1.下列各组物质中属于同分异构体的是( )
| A. | H2O和D2O | B. | 14C和12C | C. |  和 和 | D. |  和 和 |
8.R、X、Y和Z是四种元素,其在常见化合物中化合价均为+2价,且X2+与单质R不反应; X2++Z═X+Z2+;Y+Z2+=Y2++Z.这四种离子被还原成0价时表现的氧化性大小符合( )
| A. | X2+>R2+>Y2+>Z2+ | B. | Y2+>Z2+>R2+>X2+ | C. | Z2+>X2+>R2+>Y2+ | D. | R2+>X2+>Z2+>Y2+ |
5.如图所示,在小烧杯中加入水和煤油各20mL,然后将一小粒金属钠放入烧杯中,观察到的现象可能为( )
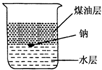

| A. | 钠在水层中反应并四处游动 | |
| B. | 钠停留在煤油层中不发生反应 | |
| C. | 钠在煤油的液面上反应并四处游动 | |
| D. | 钠在水与煤油的界面处反应并上下跳动 |