题目内容
 图中,A、B、C、D、E是常见单质,其中B、C、E为金属.G、H、I、F是B、C、D、E分别和A形成的化合物,G物质有磁性.
图中,A、B、C、D、E是常见单质,其中B、C、E为金属.G、H、I、F是B、C、D、E分别和A形成的化合物,G物质有磁性.已知:①C与G反应生成B和H且放出大量的热,该反应可用于焊接铁轨;
②I是一种常见的温室气体,它和E可以发生反应:2E+I
| ||
(1)C与G反应的化学方程式为
(2)单质A的分子式为
(3)C与NaOH溶液反应的化学方程式为
(4)过量I与NaOH溶液反应的离子方程式为
考点:无机物的推断
专题:
分析:A、B、C、D、E是常见单质,由①反应2C+G
2B+H,并放出大量的热,该反应可用于铁轨的焊接,则C为Al,G物质有磁性,为Fe3O4,B为Fe,H为Al2O3,A+C→H,所以A为O2,I是一种常见的温室气体,I为CO2,它和E可以发生反应:2E+I
2F+D,F中E元素的质量分数为60%,则F为MgO,E为Mg,D为C,结合物质的性质来解答.
| ||
| ||
解答:
解:A、B、C、D、E是常见单质,由①反应2C+G
2B+H,并放出大量的热,该反应可用于铁轨的焊接,则C为Al,G物质有磁性,为Fe3O4,B为Fe,H为Al2O3,A+C→H,所以A为O2,I是一种常见的温室气体,I为CO2,它和E可以发生反应:2E+I
2F+D,F中E元素的质量分数为60%,则F为MgO,E为Mg,D为C,
(1)①反应2C+G
2B+H,并放出大量的热,该反应可用于铁轨的焊接,为铝热反应,方程式为:8Al+3Fe3O4
9Fe+4Al2O3,
故答案为:8Al+3Fe3O4
9Fe+4Al2O3;
(2)A为O2,I是一种常见的温室气体,I为CO2,为二氧化碳,故答案为:O2;二氧化碳;
(3)C为Al,与氢氧化钠反应生成偏铝酸钠和氢气,方程式为2Al+2H2O+2NaOH═2NaAlO2+3H2↑,
故答案为:2Al+2H2O+2NaOH═2NaAlO2+3H2↑;
(4)I为CO2,过量I与NaOH溶液反应的离子方程式为CO2+OH-═HCO3-,故答案为:CO2+OH-═HCO3-.
| ||
| ||
(1)①反应2C+G
| ||
| ||
故答案为:8Al+3Fe3O4
| ||
(2)A为O2,I是一种常见的温室气体,I为CO2,为二氧化碳,故答案为:O2;二氧化碳;
(3)C为Al,与氢氧化钠反应生成偏铝酸钠和氢气,方程式为2Al+2H2O+2NaOH═2NaAlO2+3H2↑,
故答案为:2Al+2H2O+2NaOH═2NaAlO2+3H2↑;
(4)I为CO2,过量I与NaOH溶液反应的离子方程式为CO2+OH-═HCO3-,故答案为:CO2+OH-═HCO3-.
点评:本题考查无机物的推断,为高频考点,明确反应①为铝热反应及反应②为Mg与二氧化碳的反应是解答本题的突破口,熟悉物质的性质即可解答,题目难度不大.

练习册系列答案
 举一反三单元同步过关卷系列答案
举一反三单元同步过关卷系列答案
相关题目
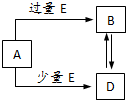 已知A、B、D、E均为中学化学中的常见物质,它们之间的转化关系如图所示(部分产物略去),则下列有关物质的推断不正确的是( )
已知A、B、D、E均为中学化学中的常见物质,它们之间的转化关系如图所示(部分产物略去),则下列有关物质的推断不正确的是( )| A、若A是铁,则E可能为稀硝酸 |
| B、若A是CuO,E是碳,则B为CO |
| C、若A是AlCl3溶液,E可能是氨水 |
| D、若A是NaOH溶液,E是CO2,则B为NaHCO3 |
在一定温度下的定容密闭容器中,当下列物理量不再变化时,不能表明反应:A(s)+2B(g)?C(g)+D(g)已达平衡的是( )
| A、B的物质的量浓度 |
| B、混合气体的密度 |
| C、混合气体的平均相对分子质量 |
| D、混合气体的压强 |
PH=5的某强酸溶液用水冲稀至原浓度的
时,这时溶液的PH值是( )
| 1 |
| 1000 |
| A、8 |
| B、5×10-3 |
| C、接近于7 |
| D、等于7 |
| E、2<PH<5 |


