题目内容
【题目】某学习小组通过下列装置探究![]() 与
与![]() 能否反应产生
能否反应产生![]() 。
。
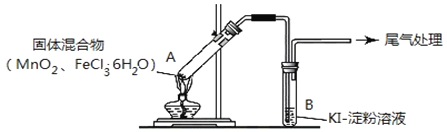
实验操作和现象如下表:
实验编号 | 操作 | 现象 |
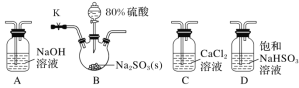
实验1 | 按如图所示加热 |
|
实验2 | 把A中的混合物换为 B中溶液换为KSCN溶液,加热。 | A中部分固体溶解,产生白雾和黄色气体,B中KSCN溶液变红 |
回答下列问题:
![]() 实验1和实验2产生白雾的原因是__________________________________________。
实验1和实验2产生白雾的原因是__________________________________________。
![]() 实验2说明黄色气体中含有___________
实验2说明黄色气体中含有___________![]() 填化学式
填化学式![]() 则实验1中
则实验1中![]() 的现象也可能是发生了另一个离子反应,则其离子方程式为_________________________________________。
的现象也可能是发生了另一个离子反应,则其离子方程式为_________________________________________。
![]() 为进一步确认黄色气体中含有
为进一步确认黄色气体中含有![]() ,该学习小组对实验1提出两种改进方案:
,该学习小组对实验1提出两种改进方案:
方案1:在A、B间增加盛有某种试剂的洗气瓶C,结果B中溶液仍变为蓝色。
方案2:将B中淀粉KI溶液替换为NaBr溶液,结果B中溶液呈橙红色,且未检出![]() 。
。
则方案1中C中盛放的试剂是______;方案2中检验![]() 的试剂名称是______,选择NaBr溶液的依据是______________________________________________________。
的试剂名称是______,选择NaBr溶液的依据是______________________________________________________。
![]() 实验1充分加热后,若反应中被氧化与未被氧化的氯元素质量之比为1:2,则A中发生反应的化学方程式为_________________________________________,用离子方程式表示尾气处理的方式___________________________________。
实验1充分加热后,若反应中被氧化与未被氧化的氯元素质量之比为1:2,则A中发生反应的化学方程式为_________________________________________,用离子方程式表示尾气处理的方式___________________________________。
![]() 该学习小组认为实验1中溶液变蓝,可能还有另外一种原因是____________________。请你设计实验方案验证此猜想___________________________________________________________________________________________________________________________________________________。
该学习小组认为实验1中溶液变蓝,可能还有另外一种原因是____________________。请你设计实验方案验证此猜想___________________________________________________________________________________________________________________________________________________。
【答案】![]() 受热水解,生成HCl气体,同时受热失去结晶水,HCl和
受热水解,生成HCl气体,同时受热失去结晶水,HCl和![]() 结合形成盐酸小液滴
结合形成盐酸小液滴 ![]()
![]() 饱和NaCl溶液 铁氰化钾溶液
饱和NaCl溶液 铁氰化钾溶液 ![]() 可以被
可以被![]() 氧化成
氧化成![]() ,但不会被
,但不会被![]() 氧化为
氧化为![]()
![]()
![]() 实验未先赶出空气,其中的
实验未先赶出空气,其中的![]() 在此条件下可能氧化
在此条件下可能氧化![]() 另取一支试管,向其中加入
另取一支试管,向其中加入![]() 淀粉溶液,再滴入几滴HCl溶液,在空气中放置,观察一段时间后溶液是否变蓝
淀粉溶液,再滴入几滴HCl溶液,在空气中放置,观察一段时间后溶液是否变蓝
【解析】
(1) HCl气体在空气中遇到水蒸气,可形成白色酸雾;
(2)根据实验现象分析产物及发生的反应;
(3)离子检验实验要排除其他离子对实验现象的干扰;
(4)结合题中信息,根据氧化还原反应规律,利用电子转移守恒,书写反应方程式;
(5)利用淀粉遇碘变蓝的原理分析。
(1)![]() 受热水解,生成HCl气体,同时受热失去结晶水,HCl和
受热水解,生成HCl气体,同时受热失去结晶水,HCl和![]() 结合形成盐酸小液滴,而形成白雾,
结合形成盐酸小液滴,而形成白雾,
(2)![]() 溶液变红,说明黄色气体含有
溶液变红,说明黄色气体含有![]() ;氯化铁具有强氧化性,可以将碘离子氧化为碘单质,反应离子方程式为:
;氯化铁具有强氧化性,可以将碘离子氧化为碘单质,反应离子方程式为:![]() ;
;
(3)方案1:除去![]() 中的
中的![]() 和HCl,若仍能观察到B中溶液仍变为蓝色,则证明原气体中确实存在
和HCl,若仍能观察到B中溶液仍变为蓝色,则证明原气体中确实存在![]() ,使用饱和NaCl溶液,可以让
,使用饱和NaCl溶液,可以让![]() 溶解,并且除去HCl气体,从而排除两个其他影响因素;
溶解,并且除去HCl气体,从而排除两个其他影响因素;
方案2:若B中观察到浅橙红色,则证明有物质能够将![]() 氧化成
氧化成![]() ,若未检查到
,若未检查到![]() ,则证明是
,则证明是![]() 氧化的
氧化的![]() ,而不是
,而不是![]() 另外,因为还原剂用的不是
另外,因为还原剂用的不是![]() ,可不用考虑
,可不用考虑![]() 的影响问题,可以用铁氰化钾溶液检验
的影响问题,可以用铁氰化钾溶液检验![]() ;NaBr比
;NaBr比![]() 淀粉溶液好的原因,在于
淀粉溶液好的原因,在于![]() 能氧化
能氧化![]() 对检验
对检验![]() 产生干扰,而
产生干扰,而![]() 不会氧化
不会氧化![]() ,不会产生干扰;
,不会产生干扰;
(4)二氧化锰与![]() 反应生成
反应生成![]() 、
、![]() 、
、![]() 及水,根据电子转移守恒可知
及水,根据电子转移守恒可知![]() 与
与![]() 的物质的量之比为1:1,若反应中被氧化与未被氧化的氯元素质量之比为1:2,说明含有HCl生成,且
的物质的量之比为1:1,若反应中被氧化与未被氧化的氯元素质量之比为1:2,说明含有HCl生成,且![]() 、
、![]() 、HCl物质的量之比为1:1:2,故反应方程式为:
、HCl物质的量之比为1:1:2,故反应方程式为:![]() ,尾气氯气与氢氧化钠反应生成氯化钠和次氯酸钠,离子方程式为:
,尾气氯气与氢氧化钠反应生成氯化钠和次氯酸钠,离子方程式为:![]() ;
;
(5)实验未先赶出空气,其中的![]() 在此条件下可能氧化
在此条件下可能氧化![]() ;作对照实验,另取一支试管,向其中加入
;作对照实验,另取一支试管,向其中加入![]() 淀粉溶液,再滴入几滴HCl溶液,在空气中放置,观察一段时间后溶液是否变蓝。
淀粉溶液,再滴入几滴HCl溶液,在空气中放置,观察一段时间后溶液是否变蓝。

 举一反三期末百分冲刺卷系列答案
举一反三期末百分冲刺卷系列答案