题目内容
15.已知Ksp(CaSO4)=9.0×10-6,Ksp(CaCO3)=5.0×10-9,Ksp(CaF2)=1.5×10-10.某溶液中含有SO42-、CO32-和F-,浓度均为0.010mol/L,向该溶液中逐滴加入0.010mol/L的CaCl2溶液时,三种阴离子产生沉淀的先后顺序为( )| A. | SO42-、CO32-、F- | B. | CO32-、SO42-、F- | C. | CO32-、F-、SO42- | D. | F-、CO32-、SO42- |
分析 析出沉淀时,CaSO4溶液中c(Ca2+)=$\frac{{K}_{sp}(CaS{O}_{4})}{c(S{{O}_{4}}^{2-})}$=$\frac{9.0×1{0}^{-6}}{0.010}$mol/L,CaCO3溶液中c(Ca2+)=$\frac{{K}_{sp}(CaC{O}_{3})}{c(C{{O}_{3}}^{2-})}$=$\frac{5.0×1{0}^{-9}}{0.010}$mol/L,CaF2溶液中c(Ca2+)=$\frac{1.5×1{0}^{-10}}{0.01{0}^{2}}$mol/L,c(Ca2+)越小,则越先生成沉淀,据此进行判断.
解答 解:析出沉淀时,CaSO4溶液中c(Ca2+)=$\frac{{K}_{sp}(CaS{O}_{4})}{c(S{{O}_{4}}^{2-})}$=$\frac{9.0×1{0}^{-6}}{0.010}$mol/L=9.0×10-4mol/L,CaCO3溶液中c(Ca2+)=$\frac{{K}_{sp}(CaC{O}_{3})}{c(C{{O}_{3}}^{2-})}$=$\frac{5.0×1{0}^{-9}}{0.010}$mol/L=5.0×10-7mol/L,CaF2溶液中c(Ca2+)=$\frac{1.5×1{0}^{-10}}{0.01{0}^{2}}$mol/L=1.5×10-6mol/L,c(Ca2+)越小,则越先生成沉淀,所以三种阴离子产生沉淀的先后顺序为CO32-、F-、SO42-,
故选C.
点评 本题考查难溶电解质的溶解平衡的计算与判断,题目难度中等,注意根据溶解度判断生成沉淀的先后顺序,需要明确组成不相似的物质,不能直接根据溶度积判断,为易错点.

| A. | 用高锰酸钾溶液滴定Na2SO3溶液至终点,滴入最后一滴高锰酸钾溶液,溶液颜色恰好由紫红色变为无色且半分钟不变色 | |
| B. | 燃料电池制作的实验中,石墨棒用海绵包裹是为了更好的固定电极 | |
| C. | pH试纸在检测溶液时不能湿润,使用石蕊试纸检测气体时需要湿润并粘在洁净玻璃棒的一端 | |
| D. | 海带中提取碘,可将灰化后的海带加水煮沸一段时间后过滤,在滤液中加入稀硫酸后转移到分液漏斗中用CCl4萃取分离 |
Ti(BH4)3是一种储氢材料,可由TiCl4和LiBH4反应制得.
(1)基态Ti3+的未成对电子数有1个.
(2)LiBH4由Li+和BH4-构成,LiBH4中不存在的作用力有C(填标号).
A.离子键 B.共价键 C.金属键 D.配位键
(3)Li、B、H元素的电负性由大到小排列顺序为H>B>Li.
(4)分子X可以通过氢键形成“笼状结构”而成为潜在的储氢材料.X一定不是BC(填标号).
A.H2O B.CH4 C.HF D.CO(NH2)2
(5)钾、镁、氟形成的某化合物的晶体结构为K+在立方晶胞的中心,Mg2+在晶胞的8个顶角,F-处于晶胞的棱边中心.由钾、镁、氟形成的该化合物的化学式为KMgF3,每个K+与12个F-配位.
(6)判断含氧酸酸性强弱的一条经验规律是含氧酸分子结构中含非羟基氧原子数越多,该含氧酸的酸性越强.如下表所示:含氧酸酸性强弱与非羟基氧原子数的关系
| 次氯酸 | 磷酸 | 硫酸 | 高氯酸 | |
| 含氧酸 | Cl-OH |  |  |  |
| 非羟基氧原子数 | 0 | 1 | 2 | 3 |
| 酸性 | 弱酸 | 中强酸 | 强酸 | 最强酸 |
 .H3PO3和H3AsO3与过量的NaOH溶液反应的化学方程式分别是:
.H3PO3和H3AsO3与过量的NaOH溶液反应的化学方程式分别是:①H3PO3+2NaOH=Na2HPO3+2H2O,
②H3AsO3+3NaOH=Na3AsO3+3H2O.
| A. | 将铜丝插入浓硫酸加热,反应后把水加入反应器中,观察硫酸铜溶液的颜色 | |
| B. | 常温下将铜丝伸入盛满氯气的集气瓶中,观察CuCl2的生成 | |
| C. | 金属钠放入硫酸铜溶液中可以置换出金属铜 | |
| D. | 将表面有铜绿[Cu2(OH)2CO3]的铜器放入盐酸中浸泡,除去铜绿 |
| A. | 聚氯乙烯分子中含碳碳双键 | B. | 以淀粉为原料可制取乙酸乙酯 | ||
| C. | 戊烷有3种同分异构体 | D. | 油脂的皂化反应属于水解反应 |
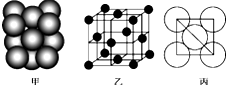 铜单质晶体中原子的堆积方式如图甲所示,其晶胞如图乙所示,原子之间相互位置关系的平面图如图丙所示.
铜单质晶体中原子的堆积方式如图甲所示,其晶胞如图乙所示,原子之间相互位置关系的平面图如图丙所示. “神七”登天标志着我国的航天事业进入了新的篇章.
“神七”登天标志着我国的航天事业进入了新的篇章.