题目内容
对于周期表中下列位置的①~⑩十种元素,请回答有关问题(用元素符号或化学式回答)
(1)②③④三种元素形成的简单离子的半径大小关系为: .
(2)最高价氧化物水化物碱性最强的物质的化学式 ,该物质水溶液与⑤的单质反应的离子方程式 .
(3)常温下为液态的单质 ,写出该单质与铁反应的化学方程式 .
(4)写出①的最高价氧化物水化物的浓溶液与金属铜反应的离子方程式 .
| ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 | |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ | ⑩ |
(2)最高价氧化物水化物碱性最强的物质的化学式
(3)常温下为液态的单质
(4)写出①的最高价氧化物水化物的浓溶液与金属铜反应的离子方程式
考点:元素周期律和元素周期表的综合应用
专题:
分析:根据元素在周期表中的位置知,①~⑩十种元素分别是N、O、F、Na、Al、Si、S、Cl、K、Br元素
(1)电子层结构相同的离子,离子半径随着原子序数增大而减小;
(2)元素的金属性越强,其最高价氧化物的水化物碱性越强;金属性最强的是K元素,Al和KOH溶液反应生成偏铝酸钾和氢气;
(3)常温下呈液态的单质是溴,溴具有强氧化性,能将铁氧化为溴化铁;
(4)①的最高价氧化物水化物的浓溶液是浓硝酸,浓硝酸和Cu反应生成硝酸铜、二氧化氮和水.
(1)电子层结构相同的离子,离子半径随着原子序数增大而减小;
(2)元素的金属性越强,其最高价氧化物的水化物碱性越强;金属性最强的是K元素,Al和KOH溶液反应生成偏铝酸钾和氢气;
(3)常温下呈液态的单质是溴,溴具有强氧化性,能将铁氧化为溴化铁;
(4)①的最高价氧化物水化物的浓溶液是浓硝酸,浓硝酸和Cu反应生成硝酸铜、二氧化氮和水.
解答:
解:根据元素在周期表中的位置知,①~⑩十种元素分别是N、O、F、Na、Al、Si、S、Cl、K、Br元素
,
(1)电子层结构相同的离子,离子半径随着原子序数增大而减小,这三种离子电子层结构相同,原子序数大小顺序是Na>F>O,所以离子半径大小顺序O>F>Na,故答案为:O>F>Na;
(2)这几种元素金属性最强的是K,其最高价氧化物的水化物是KOH;金属性最强的是K元素,Al和KOH溶液反应生成偏铝酸钾和氢气,离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑,
故答案为:KOH;2Al+2OH-+2H2O=2AlO2-+3H2↑;
(3)常温下呈液态的单质是溴,溴具有强氧化性,能将铁氧化为溴化铁,反应方程式为3Br2+2Fe=2FeBr3,故答案为:3Br2+2Fe=2FeBr3;
(4)①的最高价氧化物水化物的浓溶液是浓硝酸,浓硝酸和Cu反应生成硝酸铜、二氧化氮和水,离子方程式为Cu+2NO3-+4H+=Cu2++2NO2↑+2H2O,故答案为:Cu+2NO3-+4H+=Cu2++2NO2↑+2H2O.
,
(1)电子层结构相同的离子,离子半径随着原子序数增大而减小,这三种离子电子层结构相同,原子序数大小顺序是Na>F>O,所以离子半径大小顺序O>F>Na,故答案为:O>F>Na;
(2)这几种元素金属性最强的是K,其最高价氧化物的水化物是KOH;金属性最强的是K元素,Al和KOH溶液反应生成偏铝酸钾和氢气,离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑,
故答案为:KOH;2Al+2OH-+2H2O=2AlO2-+3H2↑;
(3)常温下呈液态的单质是溴,溴具有强氧化性,能将铁氧化为溴化铁,反应方程式为3Br2+2Fe=2FeBr3,故答案为:3Br2+2Fe=2FeBr3;
(4)①的最高价氧化物水化物的浓溶液是浓硝酸,浓硝酸和Cu反应生成硝酸铜、二氧化氮和水,离子方程式为Cu+2NO3-+4H+=Cu2++2NO2↑+2H2O,故答案为:Cu+2NO3-+4H+=Cu2++2NO2↑+2H2O.
点评:本题考查位置结构性质及其关系,涉及物质性质、元素周期律等知识点,明确元素位置、物质性质及元素周期律递变规律即可解答,注意溴和铁反应生成铁盐.

练习册系列答案
相关题目
氢化铵(NH4H)与氯化铵的结构相似,又知NH4H与水反应有H2生成,下列叙述不正确的是( )
| A、NH4H是离子化合物 |
| B、NH4H中含有离子键和共价键 |
| C、NH4H与水反应时,NH4H是氧化剂 |
| D、NH4H固体投入少量的水中,有两种气体生成 |
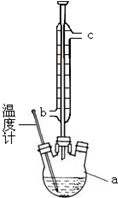 阿司匹林(乙酰水杨酸)已应用百年,成为医药史上三大经典药物之一,至今它仍是世界上应用最广泛的解热、镇痛和抗炎药,也是作为比较和评价其他药物的标准制剂.乙酰水杨酸受热易分解,分解温度为128~135℃.某学习小组在实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成该物质,设计的合成路线为:
阿司匹林(乙酰水杨酸)已应用百年,成为医药史上三大经典药物之一,至今它仍是世界上应用最广泛的解热、镇痛和抗炎药,也是作为比较和评价其他药物的标准制剂.乙酰水杨酸受热易分解,分解温度为128~135℃.某学习小组在实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成该物质,设计的合成路线为:


 的合成路线流程图(无机试剂任用).合成路线流程图示例如下:H2C═CH2
的合成路线流程图(无机试剂任用).合成路线流程图示例如下:H2C═CH2