题目内容
下列表示对应化学反应的离子方程式正确的是( )
| A、Na2O2溶于水产生O2:2O22-+2H2O═O2↑+4OH- |
| B、向氨水通入足量SO2:SO2+2NH3?H2O═2NH4++SO32-+H2O |
| C、次氯酸钠与浓盐酸反应产生Cl2:ClO-+Cl-+H2O═Cl2↑+2OH- |
| D、碳酸氢钠溶液和少量氢氧化钡溶液混合:Ba2++2OH-+2HCO3-═BaCO3↓+CO32-+2H2O |
考点:离子方程式的书写
专题:
分析:A.氧化物要写化学式;
B.过量二氧化硫时,二者反应生成亚硫酸氢铵;
C.二者反应生成氯气、水;
D.少量氢氧化钡时,二者反应生成碳酸钡、碳酸钠和水.
B.过量二氧化硫时,二者反应生成亚硫酸氢铵;
C.二者反应生成氯气、水;
D.少量氢氧化钡时,二者反应生成碳酸钡、碳酸钠和水.
解答:
解:A.金属氧化物写化学式,离子方程式为2Na2O2+2H2O═O2↑+4OH-+4Na+,故A错误;
B.足量二氧化硫和一水合氨反应生成亚硫酸氢铵,离子方程式为SO2+NH3?H2O═NH4++HSO32-+H2O,故B错误;
C.次氯酸钠和浓盐酸反应生成氯气和水,离子方程式为ClO-+Cl-+2H+═Cl2↑+H2O,故C错误;
D.碳酸氢钠溶液和少量氢氧化钡溶液反应生成碳酸钡、碳酸钠和水,离子方程式为Ba2++2OH-+2HCO3-═BaCO3↓+CO32-+2H2O,故D正确;
故选D.
B.足量二氧化硫和一水合氨反应生成亚硫酸氢铵,离子方程式为SO2+NH3?H2O═NH4++HSO32-+H2O,故B错误;
C.次氯酸钠和浓盐酸反应生成氯气和水,离子方程式为ClO-+Cl-+2H+═Cl2↑+H2O,故C错误;
D.碳酸氢钠溶液和少量氢氧化钡溶液反应生成碳酸钡、碳酸钠和水,离子方程式为Ba2++2OH-+2HCO3-═BaCO3↓+CO32-+2H2O,故D正确;
故选D.
点评:本题考查了离子方程式的书写,单质、气体、沉淀、弱电解质、氧化物等都要写化学式,明确离子方程式的书写规则是解本题关键,再结合反应物、产物书写方程式,注意要遵循客观事实、原子守恒、电荷守恒、转移电子守恒,有时离子反应还与反应物的量有关,如BD,为易错点.

练习册系列答案
相关题目
己知:
2H2(g)+O2(g)=2H2O(g)△H1
H2(g)+Cl2(g)=2HCl(g)△H2
4HCl(g)+O2(g)=2Cl2(g)+2H2O△H3
N2(g)+3H2(g)?2NH3(g)△H4
2NH3(g)+3Cl2(g)=N2(g)+6HCl(g)△H5
下列关于上述反应焓变的判断正确的是( )
2H2(g)+O2(g)=2H2O(g)△H1
H2(g)+Cl2(g)=2HCl(g)△H2
4HCl(g)+O2(g)=2Cl2(g)+2H2O△H3
N2(g)+3H2(g)?2NH3(g)△H4
2NH3(g)+3Cl2(g)=N2(g)+6HCl(g)△H5
下列关于上述反应焓变的判断正确的是( )
| A、△H1>0,△H2>0 |
| B、△H3>0,△H4>0 |
| C、△H2=△H4+△H5 |
| D、△H3=△H1-2△H2 |
下列指定反应的离子方程式正确的是( )
| A、用稀硫酸去除铜器表面的Cu2(OH)2CO3:Cu2(OH)2CO3+4H+=2Cu2++CO2↑+3H2O |
| B、用稀硝酸去除试管内壁的银镜:Ag+NO3-+2H+=Ag++NO2↑+H2O |
| C、向AlCl3溶液中加入氨水制Al(OH)3:Al3++3OH-=Al(OH)3↓ |
| D、向FeI2溶液中加入盐酸和过量的H2O2:2I-+H2O2+2H+=I2+2H2O |
下列关于35Cl的说法正确的是( )
| A、35Cl2与37Cl2互为同位素 |
B、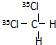 和 和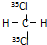 互为同分异构体 互为同分异构体 |
| C、与37Cl的得电子能力相同 |
| D、35Cl-和与它核外电子排布相同的微粒化学性质相同 |
由2-氯丙烷制得少量的 ,需要经过下列几步反应( )
,需要经过下列几步反应( )
 ,需要经过下列几步反应( )
,需要经过下列几步反应( )| A、加成→消去→取代 |
| B、消去→加成→水解 |
| C、取代→消去→加成 |
| D、消去→加成→消去 |



