题目内容
20.某无色溶液中含有大量的Ba2+、NH${\;}_{4}^{+}$、Cl-,在该溶液中还可能大量存在的离子是( )| A. | Fe3+ | B. | C032- | C. | OH- | D. | Mg2+ |
分析 无色溶液可排除 Cu2+、Fe2+、Fe3+、MnO4-等有色离子的存在,
A.铁离子为有色离子,不满足溶液无色的条件;
B.碳酸根离子与钡离子反应生成碳酸钡沉淀;
C.铵根离子与氢氧根离子反应;
D.镁离子为无色离子,不与钡离子、铵根离子和氯离子反应.
解答 解:溶液无色时可排除 Cu2+、Fe2+、Fe3+、MnO4-等有色离子的存在,
A.Fe3+为有色离子,不满足溶液无色的要求,故A错误;
B.C032-与Ba2+发生反应,在溶液中不能大量共存,故B错误;
C.OH-、NH4+反应,在溶液中不能大量共存,故C错误;
D.Mg2+为无色离子,Mg2+不与Ba2+、NH4+、Cl-反应,在溶液中能够大量共存,故D正确;
故选D.
点评 本题考查离子共存,为高考的高频题,题目难度中等,注意明确离子不能大量共存的一般情况:能发生复分解反应的离子之间;能发生氧化还原反应的离子之间;能发生络合反应的离子之间(如 Fe3+和 SCN-)等;还应该注意题目所隐含的条件,如无色时可排除 Cu2+、Fe2+、Fe3+、MnO4-等有色离子的存在.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
11.2SO2+O2$?_{△}^{催化剂}$2SO3是工业制硫酸的一步重要反应,下列关于该反应的说法正确的是( )
| A. | 使用催化剂不影响反应速率 | B. | 升高体系温度能加快反应速率 | ||
| C. | 减小SO2的浓度能加快反应速率 | D. | 反应中SO2能100%转化为SO3 |
8.下列措施中,不能有效减缓金属腐蚀的是( )
| A. | 金属护栏表面涂漆 | B. | 地下钢管连接镁块 | ||
| C. | 汽车底盘喷涂高分子膜 | D. | 水中的钢闸门连接电源的正极 |
15.下列物质属于酸的是( )
| A. | NaHCO3 | B. | P2O5 | C. | HClO4 | D. | KOH |
5.已知:Pb元素在化合物中有+4和+2两种价态:Pb02受热分解可生成Pb304、Pb0和O2:+4价的Pb能氧化浓盐酸生成Cl2 PbO能与浓盐酸反应但不能将其氧化.现将1.4mol Pb02加热一段时间分解得到O2和固体甲,向甲中加入足量的浓盐酸得到Cl2.反应生成的O2和Cl2的物质的盘之比为2:3,下列说法正确的是 ( )
| A. | 甲可能是Pb304和PbO的混合物 | |
| B. | 整个反应过程中转移电子的总量为2.1mol | |
| C. | 若甲与浓盐酸充分反应,则需要消耗HCl的总量为2.8 mol | |
| D. | 甲中各物质的物质的量之比可能是n(PbO2):n(Pb304):n(PbO)=3:3:2 |
9.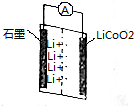 某锂离子二次电池装置如图所示,其放电时的总反应为Li1-xCoO2+LixC6═6C+LiCoO2.下列说法正确的是( )
某锂离子二次电池装置如图所示,其放电时的总反应为Li1-xCoO2+LixC6═6C+LiCoO2.下列说法正确的是( )
 某锂离子二次电池装置如图所示,其放电时的总反应为Li1-xCoO2+LixC6═6C+LiCoO2.下列说法正确的是( )
某锂离子二次电池装置如图所示,其放电时的总反应为Li1-xCoO2+LixC6═6C+LiCoO2.下列说法正确的是( )| A. | 石墨为正极 | |
| B. | 充电时,阳极质量不变 | |
| C. | 充电时,阴极反应式为xLi-xe-═xLi+ | |
| D. | 放电时,正极反应为xLi+Li1-xCoO2+xe-═LiCoO2 |
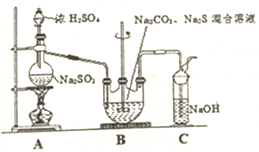 硫代硫酸钠晶体(Na2S203•5H20)俗名“大苏打”.己知它易溶于水,难溶于乙醇,加热和遇酸易分解.某实验室模拟工业硫化碱法制取硫代硫酸钠,其反应装置及所需试剂如图:
硫代硫酸钠晶体(Na2S203•5H20)俗名“大苏打”.己知它易溶于水,难溶于乙醇,加热和遇酸易分解.某实验室模拟工业硫化碱法制取硫代硫酸钠,其反应装置及所需试剂如图: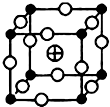 卤族元素是典型的非金属元素,卤素单质及其化合物在生产和生活中都有重要的用途.
卤族元素是典型的非金属元素,卤素单质及其化合物在生产和生活中都有重要的用途. 、
、 、
、 分别代表一种离子),晶胞边长为anm(1nm=10-9m),该晶体的化学式为KMgF3,该晶体的密度为$\frac{0.1993}{{a}^{3}}$g•cm-3.
分别代表一种离子),晶胞边长为anm(1nm=10-9m),该晶体的化学式为KMgF3,该晶体的密度为$\frac{0.1993}{{a}^{3}}$g•cm-3.