题目内容
14. 氯酸钾和亚硫酸氢钾溶液能发生氧化还原反应:ClO3-+3HSO3-═3SO42-+Cl-+3H+.已知该反应的速率随c(H+)的增大而加快.下列为用ClO3-在单位时间内物质的量浓度变化表示的该反应v-t图.下列说法中不正确的是( )
氯酸钾和亚硫酸氢钾溶液能发生氧化还原反应:ClO3-+3HSO3-═3SO42-+Cl-+3H+.已知该反应的速率随c(H+)的增大而加快.下列为用ClO3-在单位时间内物质的量浓度变化表示的该反应v-t图.下列说法中不正确的是( )| A. | 反应开始时速率增大可能是c(H+)所致 | |
| B. | 纵坐标为v(Cl-)的v-t曲线与图中曲线完全重合 | |
| C. | 图中阴影部分的面积表示t1-t2时间内ClO3-的物质的量的减少量 | |
| D. | 后期反应速率下降的主要原因是反应物浓度减少 |
分析 A.由题目信息可知反应的速率随c(H+)的增大而加快;
B.先根据电子得失守恒和原子守恒配平方程式,然后根据速率之比等于化学计量数之比;
C.先根据电子得失守恒和原子守恒配平方程式,然后根据改变的物质的量之比等于化学计量数之比;
D.根据随着反应的进行,反应物的浓度减少,反应速率减小.
解答 解:A.由方程式:ClO3-+HSO3--SO42-+Cl-+H+可知:反应开始时随着反应的进行,c(H+)不断增大,反应的速率加快由题目信息可知反应的速率随c(H+)的增大而加快,故A正确;
B.在反应中ClO3-+HSO3--SO42-+Cl-+H+,1molClO3-参加氧化还原反应得到6mol电子,1mol亚硫酸氢根离子参加氧化还原反应失去2mol电子,所以得失电子的最小公倍数是6,则ClO3-的计量数是1,亚硫酸氢根离子的计量数是3,其它原子根据原子守恒来配平,所以该方程式为:ClO3-+3HSO3-=3SO42-+Cl-+3H+,v(ClO3-):v(Cl-)=1:1,纵坐标为v(Cl-)的v-t曲线与图中曲线重合,故B正确;
C.在反应中ClO3-+HSO3--SO42-+Cl-+H+,1molClO3-参加氧化还原反应得到6mol电子,1mol亚硫酸氢根离子参加氧化还原反应失去2mol电子,所以得失电子的最小公倍数是6,则ClO3-的计量数是1,亚硫酸氢根离子的计量数是3,其它原子根据原子守恒来配平,所以该方程式为:ClO3-+3HSO3-=3SO42-+Cl-+3H+,△n(Cl-):△n(ClO3-)=1:1,所以图中阴影部分“面积”可以表示t1-t2时间为c(Cl-)增加,故C错误;
D.随着反应的进行,反应物的浓度减少,反应速率减小,所以后期反应速率下降的主要原因是反应物浓度减小,故D正确;
故选C.
点评 本题主要考查了外界条件对化学反应速率的有关知识,为高频考点,侧重于学生的分析、计算能力的考查,难度不大,需要注意的是要抓住题目的信息是解答A选项的关键.

 探究与巩固河南科学技术出版社系列答案
探究与巩固河南科学技术出版社系列答案| A. | 保持容器容积不变,向其中加入1 mol H2(g),再将平衡时反应速率一定加快 | |
| B. | 保持容器容积不变,向其中加入1 mol N2(N2不参加反应),反应速率一定加快 | |
| C. | 保持容器内气体压强不变,向其中加入1 mol N2(N2不参加反应),再次平衡时反应速率一定加快 | |
| D. | 保持容器内气体压强不变,向其中加入1 mol H2(g)和1 mol I2(g),再次平衡时反应速率一定加快 |
| 元素代号 | L | M | X | R | T |
| 原子半径/nm | 0.160 | 0.143 | 0.102 | 0.089 | 0.074 |
| 主要化合价 | +2 | +3 | +6、-2 | +2 | -2 |
①R的氧化物对应的水化物可能具有两性
②X单质可在氧气中燃烧生成XO3
③离子半径大小:r(M3+)<r(T2-)
④L2+和X2-的核外电子数相等.
| A. | ①④ | B. | ①③ | C. | ②④ | D. | ①②③ |
(1)用太阳能将CO2转化成O2和C(石墨烯),其设想如图1:
①Fe3O4中Fe的化合价是+2和+3;
②重整系统发生反应的化学方程式为6FeO+CO2═2Fe3O4+C.
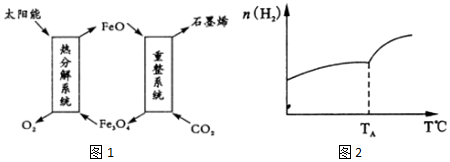
(2)二氧化碳和氢气在催化剂作用下可制取低碳烯烃.在一密闭容器中分别投入1molCO2、3molH2,发生反应:2CO2(g)+6H2(g)?C2H4 (g)+4H2O(g)△H;在不同温度下,用传感技术测出平衡时H2的物质的量变化关系如图2所示.
①其它条件不变,起始时若按lmolCO2、2molH2进行投料,CO2转化率将减小(填“增大”、“减小”或“不变”);
②△H<0(填“>”“<”“不能确定”).
③若测试中体系内无氧气产生,试结合图示推断热稳定性C2H4<H2O (填“>”“<”“不能确定”).
(3)用氨水吸收CO2制化肥(NH4HCO3)
①已知:NH3•H2O(aq)?NH4+(aq)+OH-(aq)△H1=a kJ•mol-1
CO2 (g)+H2O(l)?H2CO3 (aq)△H2=bkJ•mol-1
H2CO3(aq)+OH-(aq)?HCO3-(aq)+H2O(l)△H3=ckJ•mol-1
则利用NH3•H2O吸收CO2制备NH4HCO3的热化学方程式为NH3•H2O+CO2═NH4++HCO3-△H=(a+b+c)kJ/mol;
②已知常温下相关数据如表:
| Kb(NH3•H2O) | 2×10-5mol•L-1 |
| Ka1(H2CO3) | 4×10-7mol•L-1 |
| Ka2(H2CO3) | 4×10-11mol•L-1 |
| A. | 甲烷的标准燃烧热为△H=-890.3 kJ•mol-1,则甲烷燃烧的热化学方程式可表示为CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-890.3 kJ•mol-1 | |
| B. | CO(g)的燃烧热是283.0 kJ•mol-1,则CO2分解的热化学方程式为:2CO2(g)═2CO(g)+O2(g)△H=+283.0 kJ•mol-1 | |
| C. | 一定条件下,将0.5 mol N2(g)和1.5 mol H2(g)置于密闭的容器中充分反应生成NH3(g),放热19.3 kJ,其热化学方程式为:N2(g)+3H2(g)?2NH3(g)△H=-38.6 kJ•mol-1 | |
| D. | 同温同压下,反应H2(g)+Cl2(g)═2HCl(g)在光照和点燃条件下的△H相同 |

| A. | 该有机物的分子式为C15H18O4 | |
| B. | 1 mol该化合物最多可以与2 mol NaOH反应 | |
| C. | 既可以催化加氢,又可以使酸性KMnO4溶液褪色 | |
| D. | 可以与NaHCO3溶液反应放出CO2气体 |
| A. | CaF2 | B. | HCl | C. | Na2O | D. | H2O |
