题目内容
18.下列化学用语的表述对应正确的是( )| A. | Na2SO3的水解:SO32-+2H2O?H2SO3+2OH- | |
| B. | NaHCO3的电离:NaHCO3?Na ++H++CO32- | |
| C. | 钢铁发生吸氧腐蚀的负极反应式:4OH-+4e-=H2O+O2↑ | |
| D. | 用惰性电极电解饱和食盐水时,阳极的电极反应式:2Cl--2e-=Cl2↑ |
分析 A、多元弱酸根的水解是分步完成;
B、NaHCO3的电离:NaHCO3=Na ++HCO3-;
C、钢铁发生吸氧腐蚀的负极,是铁发生氧化反应,正极是氧气得电子,反应式:4OH-+4e-=H2O+O2↑;
D、电解池阳极发生氧化反应.
解答 解:A、多元弱酸根的水解是分步完成,所以Na2SO3的水解反应方程式为:SO32-+H2O?HSO3-+OH-,故A错误;
B、NaHCO3的电离:NaHCO3=Na ++HCO3-,故B错误;
C、钢铁发生吸氧腐蚀的负极,是铁发生氧化反应,正极是氧气得电子,反应式:4OH-+4e-=H2O+O2↑,而负极反应式为:Fe-2e-=Fe2+,故C错误;
D、电解池阳极发生氧化反应,电极反应式为:2Cl--2e-=Cl2↑,故D正确;
故选D.
点评 本题考查盐的水解和电离反应方程式的书写和电化学的相关知识,学生成要清楚多元弱酸根离子的水解是分步完成,而不是一步完成,综合性强,有一定的难度.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
6.在同温、同压下,某有机物与过量Na反应得到V1 L氢气,另取一份等量的该有机物与足量NaHCO3反应得V2 L二氧化碳,若V1=V2≠0,则有机物可能是( )
| A. | CH3CH2OH | B. | HOOC-COOH | C. | 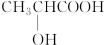 | D. | CH3COOH |
3.下列电子排布式表示基态原子的电子排布的是( )
| A. | 1s12s1 | B. | 1s22s12p1 | C. | 1s22s22p63s2 | D. | 1s22s22p63p1 |
7.下列实验的现象与对应结论均正确的是( )
| 选项 | 操作 | 现象 | 结论 |
| A | 将浓硫酸滴到蔗糖表面 | 固体变黑膨胀 | 浓硫酸有脱水性和强氧化性 |
| B | 常温下将Al片放入浓硝酸中 | 无明显现象 | Al与浓硝酸不反应 |
| C | 向AlCl3溶液中滴加过量NaOH溶液 | 溶液澄清 | Al3+与NaOH能大量共存 |
| D | 将KI和FeCl3溶液在试管中混合后,加入CCl4,振荡,静置 | 下层溶液显紫红色 | 氧化性:Fe3+>I2 |
| A. | A | B. | B | C. | C | D. | D |
8.下列变化中,不需要破坏化学键的是( )
| A. | 干冰气化 | B. | 食盐熔化 | C. | 氯化钙溶于水 | D. | 小苏打受热分解 |

