题目内容
I2在KI溶液中存在下列平衡:I2(aq)+I-(aq)?I3-(aq).测得不同温度下该反应的平衡常数值如下表:
下列说法正确的是( )
| t/℃ | 5 | 15 | 25 | 35 | 50 |
| K | 1100 | 841 | 680 | 533 | 409 |
| A、反应I2(aq)+I-(aq)?I3-(aq)的△H>0 |
| B、利用该反应可以除去硫粉中少量的碘单质 |
| C、在上述体系中加入苯,平衡不移动 |
| D、25℃时,向溶液中加入少量KI固体,平衡常数K小于680 |
考点:化学平衡的影响因素
专题:化学平衡专题
分析:A.由表中数据可知,温度越大平衡常数越小,说明升高温度平衡向逆反应方向移动,据此判断;
B.硫难溶于水,而碘单质与I-形成I3-而溶于水,可以达到除去少量碘的目的;
C.加入苯,碘能溶于苯,这样水中碘的浓度变小,平衡向逆左移动;
D.平衡常数只受温度影响,与物质的浓度无关.
B.硫难溶于水,而碘单质与I-形成I3-而溶于水,可以达到除去少量碘的目的;
C.加入苯,碘能溶于苯,这样水中碘的浓度变小,平衡向逆左移动;
D.平衡常数只受温度影响,与物质的浓度无关.
解答:
解:A.由表中数据可知,温度越大平衡常数越小,说明升高温度平衡向逆反应方向移动,故正反应方向为放热反应,即△H<0,故A错误;
B.硫难溶于水,而碘单质与I-形成I3-而溶于水,可以达到除去少量碘的目的,故B正确;
C.加入苯,碘能溶于苯,这样水中碘的浓度变小,平衡向逆左移动,故C错误;
D.加入KI固体,平衡向右移动,但平衡常数只受温度影响,与物质的浓度无关,加入少量KI固体,平衡常数K不变,故D错误;
故选B.
B.硫难溶于水,而碘单质与I-形成I3-而溶于水,可以达到除去少量碘的目的,故B正确;
C.加入苯,碘能溶于苯,这样水中碘的浓度变小,平衡向逆左移动,故C错误;
D.加入KI固体,平衡向右移动,但平衡常数只受温度影响,与物质的浓度无关,加入少量KI固体,平衡常数K不变,故D错误;
故选B.
点评:本题考查温度对化学平衡的影响、化学平衡常数及影响元素,难度不大,注意对基础知识的理解掌握.

练习册系列答案
相关题目
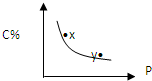 对于mA(s)+nB(g)?pC(g)的可逆反应,在一定温度下C的百分含量与压强的关系如图所示,则下列判断正确的是( )
对于mA(s)+nB(g)?pC(g)的可逆反应,在一定温度下C的百分含量与压强的关系如图所示,则下列判断正确的是( )| A、m+n<p |
| B、n>p |
| C、x点的状态是v正>v逆 |
| D、y点的状态是v正<v逆 |
下列说法中正确的是( )
| A、化学科学与其他科学分支的联系不密切 |
| B、化学研究的主要目的就是认识分子 |
| C、化学家可以制造出自然界中不存在的物质 |
| D、化学研究会造成严重的环境污染,最终人类将毁灭在化学物质中 |
检验下列有机物的方法中正确的是( )
| A、向氯仿中加入AgNO3溶液检验其含有氯元素 |
| B、用酸性KMnO4溶液鉴别乙烯和乙炔 |
| C、用FeCl3溶液鉴别苯和苯酚 |
| D、用新制Cu(OH)2悬浊液鉴别乙醇、乙醛和乙酸 |
用NA表示阿伏加德罗数的值.下列叙述正确的是( )
| A、25°C时,pH=3的1.0L NaHSO3溶液中,含Na+数目为0.001 NA |
| B、0.1mol Fe在0.1mol Cl2中充分燃烧,转移的电子数为0.3NA |
| C、2.3g甲苯和丙三醇的混合物中,含氢原子数目为0.2 NA |
| D、标准状况下,22.4L乙醇中含有的氧原子数为1.0NA |
下列离子方程式正确的是( )
| A、碳酸钙和醋酸 CaCO3+2H+═Ca2++H2O+CO2↑ | ||||
| B、碳酸氢钙溶液和足量氢氧化钠溶液 Ca2++HCO3-+OH-=CaCO3↓+H2O | ||||
| C、铜和稀硝酸反应 Cu+4H++NO3?═Cu2++NO↑+2H2O | ||||
D、硫酸铵溶液和氢氧化钠溶液共热 NH4++OH-
|