题目内容
【题目】关于Na2CO3和NaHCO3性质的说法正确的是( )
A. 在水中的溶解性:NaHCO3>Na2CO3 B. 热稳定性:NaHCO3<Na2CO3
C. 与酸反应的速率:NaHCO3<Na2CO3 D. 只可能让NaHCO3转化成Na2CO3
【答案】B
【解析】A.常温下,向饱和碳酸钠溶液中通入二氧化碳气体,有碳酸氢钠晶体析出,可知常温时水中溶解性:Na2CO3>NaHCO3,故A错误;B.NaHCO3不稳定,加热易分解:2NaHCO3![]() Na2CO3+CO2↑+H2O,碳酸钠受热不分解,比较稳定,故B正确;C.分别滴加同浓度的酸溶液,反应离子方程式为CO32-+2H+═CO2↑+H2O,HCO3-+H+═H2O+CO2↑,相同条件下NaHCO3比Na2CO3反应放出气体剧烈,故C错误;D.Na2CO3能与二氧化碳、水反应转化成NaHCO3,NaHCO3能分解转化成Na2CO3,二者可相互转化,故D错误;故选B。
Na2CO3+CO2↑+H2O,碳酸钠受热不分解,比较稳定,故B正确;C.分别滴加同浓度的酸溶液,反应离子方程式为CO32-+2H+═CO2↑+H2O,HCO3-+H+═H2O+CO2↑,相同条件下NaHCO3比Na2CO3反应放出气体剧烈,故C错误;D.Na2CO3能与二氧化碳、水反应转化成NaHCO3,NaHCO3能分解转化成Na2CO3,二者可相互转化,故D错误;故选B。

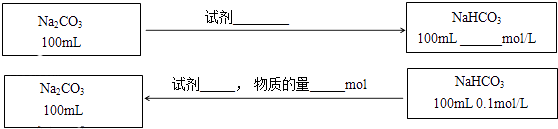
【题目】某同学在实验室研究Na2CO3和NaHCO3的性质及相互转化.
(1)分别向浓度均为0.1mol/LNa2CO3及NaHCO3溶液中滴加几滴酚酞试剂:
①Na2CO3溶液由无色变为红色,其原因是 .
②NaHCO3溶液也由无色变为红色,其原因是 .
③比较两份溶液的颜色,红色较浅的是(填化学式).
(2)研究NaHCO3与CaCl2的反应.
实验序号 | 实验操作 | 实验现象 |
实验1 | 向2mL 0.001mol/L NaHCO3溶液中加入1mL 0.1mol/LCaCl2溶液 | 无明显变化.用激光笔照射,没有出现光亮的通路. |
实验2 | 向2mL 0.1mol/L NaHCO3溶液中加入1mL 0.1mol/LCaCl2溶液 | 略显白色均匀的浑浊,用激光笔照射,出现光亮的通路. |
①实验1中没有出现白色浑浊的原因是 .
②实验2中形成的分散系属于 .
③用离子方程式表示实验2中发生的反应 .
(3)在不引入其他杂质的前提下,实现Na2CO3与NaHCO3之间的转化,请在图中标出所用的试剂、用量或物质的浓度(反应前后溶液体积的变化可忽略).