题目内容
11.${\;}_{1}^{3}$H可用作制造氢弹的原料.下列关于${\;}_{1}^{3}$H的说法,正确的是( )| A. | 质子数是2 | B. | 电子数是2 | C. | 质量数是3 | D. | 中子数是1 |
分析 元素符号左下角数字表示质子数,左上角数字表示质量数,中子数=质量数-质子数,原子中质子数=原子核外电子数.
解答 解:A.元素符号左下角数字表示质子数,${\;}_{1}^{3}$H的质子数是1,故A错误;
B.原子中质子数=原子核外电子数,${\;}_{1}^{3}$H的电子数是1,故B错误;
C.元素符号左上角数字表示质量数,${\;}_{1}^{3}$H的质量数是3,故C正确;
D.${\;}_{1}^{3}$H的中子数=质量数-质子数=3-1=2,故D错误.
故选C.
点评 本题考查原子的构成,明确核外电子和核内质子数的关系、质子数和中子数、质量数的关系是解本题的关键,题目难度不大.

练习册系列答案
相关题目
15.下列关于有机物 的说法中不正确的是( )
的说法中不正确的是( )
 的说法中不正确的是( )
的说法中不正确的是( )| A. | 不能发生消去反应 | |
| B. | 所有的碳原子在同一个平面上 | |
| C. | 能够发生加成反应 | |
| D. | 水解生成的有机物可与NaOH溶液反应 |
16.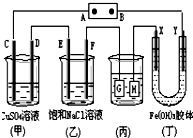 如图所示的装置,C、D、E、F、X、Y都是惰性电极.将电源接通后,向(乙)中滴入酚酞溶液,在F极附近显红色.则以下说法正确的是( )
如图所示的装置,C、D、E、F、X、Y都是惰性电极.将电源接通后,向(乙)中滴入酚酞溶液,在F极附近显红色.则以下说法正确的是( )
 如图所示的装置,C、D、E、F、X、Y都是惰性电极.将电源接通后,向(乙)中滴入酚酞溶液,在F极附近显红色.则以下说法正确的是( )
如图所示的装置,C、D、E、F、X、Y都是惰性电极.将电源接通后,向(乙)中滴入酚酞溶液,在F极附近显红色.则以下说法正确的是( )| A. | 电源B极是正极 | |
| B. | 装置(丁)中Y极附近红褐色变深,说明氢氧化铁胶粒带正电荷 | |
| C. | 欲用(丙)装置给铜镀银,H应该是Ag,电镀液是AgNO3溶液 | |
| D. | (甲)、(乙)装置的C、D、E、F电极均有单质生成,其物质的量之比为1:2:2:2 |


 .
.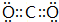 .
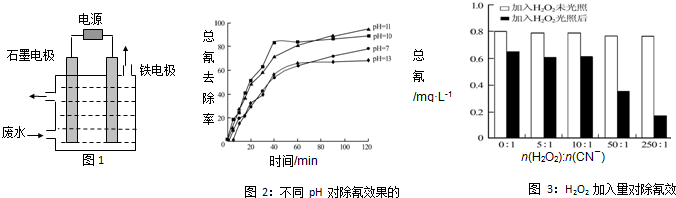
.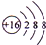 .
.
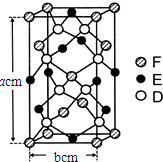 已知A、B、C、D四种短周期元素,它们的核电荷数依次增大.A与C原子的基态电子排布中L能层都有两个未成对电子,C、D同主族. E、F都是第四周期元素,E原子的基态电子排布中有4个未成对电子,F原子除最外能层只有1个电子外,其余各能层均为全充满.根据以上信息填空:
已知A、B、C、D四种短周期元素,它们的核电荷数依次增大.A与C原子的基态电子排布中L能层都有两个未成对电子,C、D同主族. E、F都是第四周期元素,E原子的基态电子排布中有4个未成对电子,F原子除最外能层只有1个电子外,其余各能层均为全充满.根据以上信息填空: ,F原子的电子排布式是1s22s22p63s23p63d104s1.
,F原子的电子排布式是1s22s22p63s23p63d104s1. .
.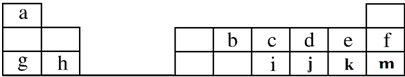
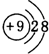 ,元素d与元素g形成的原子个数比为1:1的化合物的电子式为
,元素d与元素g形成的原子个数比为1:1的化合物的电子式为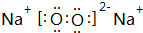 ;(用元素符号填空)
;(用元素符号填空)