题目内容
5.A、B、C、D、E是中学所学的无机试剂.B、C、D、E都是可溶性正盐(不包括复盐);且组成它们的阴、阳离子均不相同,组成它们的离子可能有:Na+、Al3+、NH4+、Ba2+、Ag+、CO32-、SO42-、OH-、Cl-、NO3-.现进行如下实验:①常温下,0.05mol/LA溶液的pH=13;C溶液显中性,D、E的溶液显酸性;
②A与B的浓溶液混合时有刺激性气味的气体产生,同时有白色沉淀生成;
③A与D的溶液混合时有白色沉淀生成,当A过量时沉淀部分溶解;
④E溶液与B、C、D的浓溶液反应均有白色沉淀生成.
根据上述实验信息,请回答下列问题.
(1)写出D的化学式:DAl2(SO4)3,A中阴离子的电子式是
 .
.(2)E溶液的实验室保存方法是保存在棕色试剂瓶中,置于冷暗处.
(3)实验测得B的溶液显碱性,则B电离产生的阳离子与阴离子的物质的量浓度的比值大于2(填“大于”“小于”或“等于”).
(4)1mol D与A反应生成沉淀的最大质量为855g.
分析 由常温下,0.05mol/LA溶液的pH=13,则A为二元强碱,所以A为Ba(OH)2;
D、E的溶液显酸性,E溶液与其余四种的浓溶液反应均有沉淀生成,则E为AgNO3;
A与D的溶液混合时有白色沉淀生成,当A过量时沉淀部分溶解,则D为铝盐,再根据溶液中的阴离子分析,D为Al2(SO4)3;
A与B的浓溶液混合时有刺激性气味的气体产生,同时有白色沉淀生成,且B显酸性,则B为(NH4)2CO3;
剩余离子为Na+和Cl-,C溶液显中性,所以C为NaCl,以此来解答.
解答 解:由常温下,0.05mol/LA溶液的pH=13,则A为二元强碱,所以A为Ba(OH)2;
D、E的溶液显酸性,E溶液与其余四种的浓溶液反应均有沉淀生成,则E为AgNO3;
A与D的溶液混合时有白色沉淀生成,当A过量时沉淀部分溶解,则D为铝盐,再根据溶液中的阴离子分析,D为Al2(SO4)3;
A与B的浓溶液混合时有刺激性气味的气体产生,同时有白色沉淀生成,且B显酸性,则B为(NH4)2CO3;
剩余离子为Na+和Cl-,C溶液显中性,所以C为NaCl,
综上可知:A为Ba(OH)2,B为(NH4)2CO3,C为NaCl,D为Al2(SO4)3,E为AgNO3;
(1)由上述分析可知D为Al2(SO4)3,A为Ba(OH)2,A中阴离子的电子式是 ,
,
故答案为:Al2(SO4)3; ;
;
(2)E为AgNO3,见光易分解,所以实验室保存在棕色试剂瓶中,置于冷暗处,
故答案为:保存在棕色试剂瓶中,置于冷暗处;
(3)B为(NH4)2CO3,实验测得B的溶液显碱性,则碳酸根离子水解程度大于铵根离子,所以(NH4)2CO3电离产生的阳离子与阴离子的物质的量浓度的比值大于2,
故答案为:大于;
(4)D为Al2(SO4)3,A为Ba(OH)2,1mol D与A反应生成沉淀的质量最大时,则反应为1molAl2(SO4)3与3molBa(OH)2反应生成沉淀为3molBaSO4和2molAl(OH)3,其质量为233×3g+78×2g=855g,
故答案为:855.
点评 本题考查无机物的推断,利用离子共存和离子反应推断物质为解答的关键,是高考的热点和难点,注意把握有特征的物质,然后结合推出的物质推导剩余的物质,最后进行验证即可,题目难度中等.

 合成氨技术的创立开辟了人工固氮的重要途径,其研究来自正确的理论指导,合成氨反应的平衡常数K值和温度的关系如下:
合成氨技术的创立开辟了人工固氮的重要途径,其研究来自正确的理论指导,合成氨反应的平衡常数K值和温度的关系如下:| 温 度(℃) | 360 | 440 | 520 |
| K值 | 0.036 | 0.010 | 0.0038 |
②理论上,为了增大平衡时H2的转化率,可采取的措施是ad.(填序号)
a.增大压强 b.使用合适的催化剂
c.升高温度 d.及时分离出产物中的NH3
(2)原料气H2可通过反应 CH4(g)+H2O (g)?CO(g)+3H2(g) 获取,已知该反应中,当初始混合气中的$\frac{n({H}_{2}O)}{n(C{H}_{4})}$恒定时,温度、压强对平衡混合气CH4含量的影响如图所示:
①图中,两条曲线表示压强的关系是:P1<P2(填“>”、“=”或“<”).
②该反应为吸热反应(填“吸热”或“放热”).
(3)原料气H2还可通过反应CO(g)+H2O(g)?CO2 (g)+H2(g) 获取.
①T℃时,向容积固定为5L的容器中充入1mol水蒸气和1mol CO,反应达平衡后,测得CO的浓度为0.08mol•L-1,则平衡时CO的转化率为60%,该温度下反应的平衡常数K值为2.25.
②保持温度仍为T℃,改变水蒸气和CO的初始物质的量之比,充入容器进行反应,下列描述能够说明体系处于平衡状态的是cd(填序号).
a.容器内压强不随时间改变
b.混合气体的密度不随时间改变
c.单位时间内生成a mol CO2的同时消耗a molH2
d.混合气中n(CO):n(H2O):n(CO2):n(H2)=1:16:6:6.
| A. | 该病毒主要通过血液向他人传染 | |
| B. | 该病毒在浓盐溶液中一定会发生变性 | |
| C. | 通常将病毒样本保存在福尔马林中 | |
| D. | 该病毒在一定条件下水解最终会生成氨基酸 |
请回答下列问题.
(1)已知在常温下测得浓度均为0.1mol•L-1的下列6种溶液的pH:
| 溶液 | CH3COONa | Na2CO3 | Na2CO3 | HClO | C6H5ONa |
| PH | 8.8 | 9.7 | 11.6 | 10.3 | 11.3 |
和较强酸的盐,如:2CH3COOH+Na2CO3═2CH3COONa+CO2↑+H2O,若换个角度看,它同时揭示出另一条
规律:碱性较强的物质发生类似反应可以生成碱性较弱的物质.依照该规律,请判断下列反应不能发生的是AD(填编号).
A.CO2+H2O+2NaClO→Na2CO3+2HClO
B.CO2+H2O+NaClO→NaHCO3+HClO
C.CO2+H2O+C6H5ONa→NaHCO3+C6H5OH
D.CO2+H2O+2C6H5ONa→Na2CO3+2C6H5OH
E.Na2CO3+C6H5OH→NaHCO3+C6H5ONa
(2)得根据前述信息判断,常温下,浓度均为0.05mol/L的下列5种物质的溶液中,pH最小的是⑤(填编号),其pH=1(填数值);pH最大的是①(填编号)
①C6H5OH②CH3COOH③HClO4④HClO⑤H2SO4
(3)一些复分解反应的发生还遵循其它的规律,下列转化都属于复分解反应:
①工业上将石灰乳与纯碱溶液混合可制得苛性的钠溶液;
②侯氏制碱法中,向饱和碳酸氢铵溶液中加入饱和食盐水可获得小苏打晶体.
请根据上述反应,总结出复分解反应的另一规律:复分解反应能向着生成更难溶物质的方向进行.
(4)根据(3)中结论,现将KI溶液和AgCl固体混合搅拌,则可以观察到的现象是白色固体变为黄色,反应的离子方程式为I-+AgCl=AgI+Cl-.
| A. | B元素的最高化合价为+4价时,其负化合价也可能为-3价 | |
| B. | A(OH)n与HnEOm不能反应 | |
| C. | HnCOm为强酸时,HxDOy一定为强酸 | |
| D. | HnDOm为强酸时,E的非金属性一定很强 |
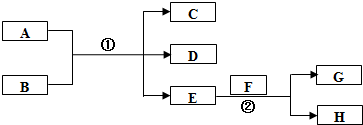
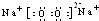 ;在反应②中,当生成2.24L的G(标准状况)时,反应转移的电子数目为0.2NA或1.024×1023.
;在反应②中,当生成2.24L的G(标准状况)时,反应转移的电子数目为0.2NA或1.024×1023.



 ;
; ;CO2的电子式
;CO2的电子式 ;NH4Cl的电子式
;NH4Cl的电子式 ;
;