��Ŀ����
(1)��Һ�У�c(H��)��10��x mol��L��1��c(OH��)��10��y mol��L��1��x��y�Ĺ�ϵ��ͼ��ʾ��

������A�㵽B�㣬�ɲ�ȡ�Ĵ�ʩΪ_________��
��T2 ��ʱ����pH=0��NaHSO4��Һ��εμӵ�pH=2 �Ĵ�����Һ�У���ˮ�������c(OH��)��______(���������С���������䡱����
����֪��T1 ��ʱ�� ����ĵ��볣��Ϊ 1.8��10��5���� T1 ��ʱ�� �� 0.5 mol��L��1�Ĵ�����Һ���ɴ��������� c(H��)Լ��ˮ������� c(H��)��__________ ����
��T2 ��ʱ����ij��Һ(����Һ���� lg [c(H+)/c(OH��)]=10)���뺬 Na+�� HS���� SO42���� K+����Һ�У�������Ӧ�����ӷ���ʽΪ___________��
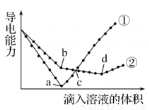
(2)�����Ϊ1 mL pH=2��һԪ��HA��HB����ˮϡ������pH����Һ�����ϵ��ͼ��ʾ��

��m��ȡֵΪ______________��
��a�����Ũ��____________b�����Ũ��(�� ��>������<������=������
���� m<4��������a�㵽c��Ĺ�����,���б���ʽ�����ݱ�����_____________��
A��c(A��) B. n(H+)�� n(OH��) C. c(H+)/c(A��) D. c(A��)/[c(HA)�� c(OH��)]
(3)��֪��25 ��ʱ��HCN��H2CO3 �ĵ���ƽ�ⳣ���ֱ�ΪK��4.9��10��10��K1��4.3��10��7��K2��5.6��10��11����NaCN��Һ��ͨ������CO2����������Ӧ�����ӷ���ʽΪ:____________��
 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�����һ�������£���ӦA(g)��2B(s) C(g)(����ӦΪ���ȷ�Ӧ)�ﵽƽ���������ͼ���жϣ�
C(g)(����ӦΪ���ȷ�Ӧ)�ﵽƽ���������ͼ���жϣ�


��1������ѹǿ���ﵽ��ƽ����� (��ͼ���Ӧ����ţ���ͬ)��A��ת����(���������С���������䡱����ͬ) ��
��2������A�������ﵽ��ƽ����� ����ʱA��ת���� ��
��ҵ�ϳɰ�N2(g)��3H2(g) 2NH3(g)��Ӧ�����е������仯����ͼ��ʾ����ͼ�ش��������⣺
2NH3(g)��Ӧ�����е������仯����ͼ��ʾ����ͼ�ش��������⣺

��1���÷�Ӧͨ���û��������������ӻ�������ʹͼ��B�㣨����ߡ����ǡ����͡�) �������� ��
��2���÷�Ӧƽ�ⳣ������ʽΪ��K�� ��������������K (���������С���������䡱����ͬ)��
��3��һ�������µ��ܱ������У��÷�Ӧ�ﵽƽ�⣬Ҫ���N2��ת���ʣ����Բ�ȡ�ĺ�����ʩ�� (����ĸ����)��
a����ѹ b��������� c������N2��Ũ�� d������H2��Ũ�� e�������NH3
����һ��������ܱ������У��������»�ѧ��Ӧ���仯ѧƽ�ⳣ��K���¶�t�Ĺ�ϵ���£�CO2(g)+H2(g)  CO(g)+H2O(g)���仯ѧƽ�ⳣ��K���¶�t�Ĺ�ϵ���±���
CO(g)+H2O(g)���仯ѧƽ�ⳣ��K���¶�t�Ĺ�ϵ���±���
t�� | 700 | 800 | 830 | 1000 | 1200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
��ش��������⣺
��1���÷�ӦΪ ��Ӧ��(����ȡ����ȡ�)
��2��830�棬�̶�����Ϊ2L���ܱ������У����������ʼŨ��Ϊc(CO) =0.1mol/L�� c(H2O) =0.3mol/L����3s��ﵽƽ�⣬��ƽ��ʱCO�����ʵ���Ϊ ��3s��CO2��ƽ����Ӧ����Ϊ ��
��3�������ж���֪�Ŀ��淴Ӧ�ﵽƽ��״̬���� (����ĸ����)��
a�������ڵ�ѹǿ���ٱ仯
b����λʱ��������amolCO2ͬʱ����amolCO
c�����������ɵ�COŨ����H2Ũ�����
d����λʱ��������amolCO2ͬʱ����2amolCO
e����λʱ��������amolCO2ͬʱ����amolH2
T��ʱ����A��B��0.32 mol��������ܱ������У�������Ӧ��A(g)��B(g) 2C(g) ��H=��a kJ��mol��1 (a>0)����Ӧ�����вⶨ���������±�������˵����ȷ���ǣ� ��
2C(g) ��H=��a kJ��mol��1 (a>0)����Ӧ�����вⶨ���������±�������˵����ȷ���ǣ� ��
t/min | 0 | 2 | 4 | 7 | 9 |
n(B)/mol | 0.32 | 0.24 | 0.22 | 0.20 | 0.20 |
A������ʼʱ�������г���0.64 mol C�����ƽ��ʱ���յ�����Ϊ0.12a kJ
B�����£� ���ѹ�����������B��Ũ�Ⱥ��������������
C������ʼʱ�������г��� 0.64 mol A �� 0.64 mol B�� ���ƽ��ʱ n(C)<0.40 mol
D�����¡����ݣ���ƽ����ϵ���ٳ���0.32 mol A���ٴ�ƽ��ʱ��B��ת��������


 2C(g)+D(g) �����ֲ�ͬ����µķ�Ӧ�������£����з�Ӧ���е�������
2C(g)+D(g) �����ֲ�ͬ����µķ�Ӧ�������£����з�Ӧ���е������� min)��1
min)��1 CO��g����Cl2��g�� ��H>0��
CO��g����Cl2��g�� ��H>0�� ����Ӧ�ﵽƽ��ʱ�����д�ʩ�������� �ں���ͨ��������� ������CO��Ũ�� �ܼ�ѹ �ݼӴ��� ��ѹͨ��������� �ߺ���ͨ��COCl2���壬�����COCl2ת���ʵ��ǣ� ��
����Ӧ�ﵽƽ��ʱ�����д�ʩ�������� �ں���ͨ��������� ������CO��Ũ�� �ܼ�ѹ �ݼӴ��� ��ѹͨ��������� �ߺ���ͨ��COCl2���壬�����COCl2ת���ʵ��ǣ� �� NaOH��Һ��pH=11
NaOH��Һ��pH=11