题目内容
【题目】一定量的铁粉和9克硫粉混合加热,待其反应后再加入过量盐酸,将生成的气体完全燃烧,共收集得9克水,则加入的铁粉质量为
A.14gB.42gC.56gD.28g
【答案】D
【解析】
铁与硫加热发生反应:Fe+S ![]() FeS,若硫粉过量,加入盐酸发生反应:FeS+2HCl=FeCl2+H2S↑,H2S燃烧生成H2O;若铁粉过量时,Fe与盐酸还会反应:Fe+2HCl=FeCl2+H2↑,此时气体为H2S和H2;根据氢元素守恒分析解答。
FeS,若硫粉过量,加入盐酸发生反应:FeS+2HCl=FeCl2+H2S↑,H2S燃烧生成H2O;若铁粉过量时,Fe与盐酸还会反应:Fe+2HCl=FeCl2+H2↑,此时气体为H2S和H2;根据氢元素守恒分析解答。
9g水的物质的量为:n(H2O)=![]() =0.5mol,铁与硫粉加热发生反应为:Fe+S
=0.5mol,铁与硫粉加热发生反应为:Fe+S ![]() FeS,若硫粉过量,加入盐酸发生反应:FeS+2HCl=FeCl2+H2S↑,生成气体为H2S,H2S燃烧生成H2O和二氧化硫,根据氢元素守恒及反应方程式可知,n(Fe)=n(H2O);当铁粉过量时,Fe与盐酸还会反应:Fe+2HCl=FeCl2+H2↑,此时气体为H2S和H2,根据氢元素守恒及反应方程式可知,铁的物质的量与水的物质的量相等,即n(Fe)=n(H2O),因此生成水的物质的量与铁粉的物质的量相等,所以混合物中铁粉的物质的量为0.5mol,质量为:56g/mol×0.5mol=28g,故选D。
FeS,若硫粉过量,加入盐酸发生反应:FeS+2HCl=FeCl2+H2S↑,生成气体为H2S,H2S燃烧生成H2O和二氧化硫,根据氢元素守恒及反应方程式可知,n(Fe)=n(H2O);当铁粉过量时,Fe与盐酸还会反应:Fe+2HCl=FeCl2+H2↑,此时气体为H2S和H2,根据氢元素守恒及反应方程式可知,铁的物质的量与水的物质的量相等,即n(Fe)=n(H2O),因此生成水的物质的量与铁粉的物质的量相等,所以混合物中铁粉的物质的量为0.5mol,质量为:56g/mol×0.5mol=28g,故选D。

【题目】卤族元素在生活中有广泛应用,根据所需知识回答下列问题。
(1)氟元素基态原子的价电子排布图:_________,卤族元素位于元素周期表______区。
(2)在一定浓度的氢氟酸溶液中,部分溶质以二分子缔合(HF)2形式存在,使HF分子缔合的作用力是_______________。
(3)BF3常温下是气体,有强烈的接受弧电子对的倾向。BF3分子的立体构型为______,固态时的晶体类型是_______,BF3与NH3相遇立即生成白色固体,写出该白色固体物质的结构式并标注出其中的配位键_____。
(4)根据下表提供的数据判断,熔点最高、硬度最大的是_______(填化学式)。
离子晶体 | NaF | MgF2 | AlF3 |
晶格能(KJ·mol-1) | 923 | 2957 | 5492 |
(5)已知NaClO2晶体中阴离子为V型,ClO2-中氯原子的弧电子对数是______,ClO2-中氯原子的杂化轨道类型为_____,HClO4比HClO2酸性强的原因是_______。
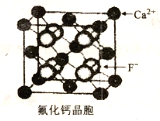
(6)CaF2晶胞如下图所示。已知:NA为阿伏伽德罗常数,棱上相邻的两个Ca2+的核间距为acm,则CaF2的密度可表示为_____g·cm-3。