题目内容
8.完全燃烧mg液态乙醇得到液态水时放出的热量为akJ.经侧定mg乙醇与Na反应时最多可生成0.5gH2,则液态乙醇完全燃烧的热化学方程式为( )| A. | C2H5OH(1)+3O2(g)=2CO2(g)+3H2O(l)△H=-akJ•mol-1 | |
| B. | C2H5OH(1)+3O2(g)=2CO2(g)+3H2O(l)△H=+$\frac{1}{2}$akJ•mol-1 | |
| C. | $\frac{1}{2}$C2H5OH(1)+$\frac{3}{2}$O2(g)=CO2(g)+$\frac{3}{2}$H2O(l)△H=+akJ•mol-1 | |
| D. | C2H5OH(1)+3O2(g)=2CO2(g)+3H2O(l)△H=-2akJ•mol-1 |
分析 0.5g氢气的物质的量为:$\frac{0.5g}{2g/mol}$=0.25mol,先根据mg乙醇与Na反应生成氢气的物质的量计算出mg乙醇的物质的量,据此可计算出1mol乙醇完全燃烧生成液态水时放出的热量,然后根据热化学方程式的书写原则写出乙醇完全燃烧的热化学方程式.
解答 解:mg乙醇与Na反应时最多可生成0.5gH2,0.5g氢气的物质的量为:$\frac{0.5g}{2g/mol}$=0.25mol,根据反应2CH3CH2OH+2Na→2CH3CH2ONa+H2↑可知,mg乙醇的物质的量为:0.25mol×2=0.5mol,
完全燃烧mg液态乙醇得到液态水时放出的热量为akJ,即0.5mol乙醇完全燃烧生成液态水放出akJ热量,则1mol乙醇完全燃烧生成液态水放出的热量为:akJ×$\frac{1mol}{0.5mol}$=2akJ,
所以乙醇燃烧的热化学方程式为:C2H5OH(1)+3O2(g)=2CO2(g)+3H2O(l)△H=-2akJ•mol-1或$\frac{1}{2}$C2H5OH(1)+$\frac{3}{2}$O2(g)=CO2(g)+$\frac{3}{2}$H2O(l)△H=-akJ•mol-1,
故选D.
点评 本题考查了热化学方程式的书写方法,题目难度不大,根据生成氢气的量正确计算出mg乙醇的物质的量为解答关键,注意掌握热化学方程式的书写原则,试题培养了学生的分析能力及化学计算能力.

练习册系列答案
 备战中考寒假系列答案
备战中考寒假系列答案
相关题目
16.下列描述中,正确的是( )
| A. | 由 CH3CH2OH(l)+3O2(g)═2CO2(g)+3H2O(g)△H=-1366.8 kJ•mol-1,可知乙醇的标准燃烧热为1366.8 kJ•mol-1 | |
| B. | 已知:C(金刚石,s)=C(石墨,s)△H<0,则金刚石比石墨稳定 | |
| C. | 已知:N2(g)+O2(g)═2NO(g)△H=+180 kJ•mol-1 2CO(g)+O2(g)═2CO2 (g)△H=-566 kJ•mol-1 则 2CO(g)+2NO(g)═N2 (g)+2CO2(g)△H=-746 kJ•mol-1 | |
| D. | OH-(aq)+H+(aq)═H2O(l)△H=-57.3 kJ•mol-1 |
3.下列有机物的命名正确的是( )
| A. |  二溴乙烷 | B. | 2-甲基-3-乙基丁烷 | ||
| C. |  2-羟基丁烷 | D. |  2,3-二甲基-1,4-戊二烯 |
20.有关反应现象的描述错误的是( )
| A. | 钠在氯气中燃烧产生黄色烟 | |
| B. | 锌和碘的混合粉末加几滴水有紫色气体产生 | |
| C. | 镁在空气中燃烧发出耀眼的白光 | |
| D. | 铜在氯气中燃烧产生棕黄色的烟 |
17.下列表示氧原子结构示意图的是( )
| A. |  | B. |  | C. |  | D. |  |
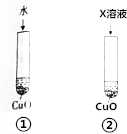 氧化铜可溶于稀硫酸,某同学为探究稀硫酸中的哪种粒子(H2O、H+、SO42-)使氧化铜溶解设计了如下实验.
氧化铜可溶于稀硫酸,某同学为探究稀硫酸中的哪种粒子(H2O、H+、SO42-)使氧化铜溶解设计了如下实验.