题目内容
【题目】我国某地粉煤灰中主要含有Al2O3,除此之外还含有Ga2O3及少量Fe2O3、CaO、MgO和SiO2等物质。已知从粉煤灰中回收铝并提取镓的工艺流程如下所示:
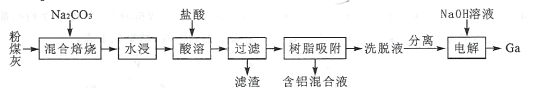
回答下列问题:
(1)焙烧前,应将粉煤灰与纯碱粉末充分混合,其原因是____;混合焙烧时,Al2O3、Ga2O3均发生类似于SiO2的反应,试写出Ga2O3在此过程中发生反应的化学方程式:____。
(2)滤渣的成分是____ ;含铝混合液中除了大量A13+之外,还有Fe3+和少量Mg2+,由混合液制取纯净Al(OH)3的实验方案是_____。
(3)洗脱液中往往还有少量Fe3+,需要进一步分离。若使Fe3+恰好完全沉淀[c(Fe3+)= l×l0-5mol·L-l]时,Ga3+浓度至少为_____mol·L-l才会开始沉淀。(已知:![]() 。)
。)
(4)电解过程中,Ga3+与NaOH溶液反应生成GaO2-,GaO2-在阴极放电,则电解方程式为____;电解过程中需要保持溶液为pH=11以上的原因是 ___。
【答案】增大反应物接触面积,加快化学反应速率 Ga2O3+Na2CO3![]() 2NaGaO2+CO2↑ H2SiO3或H4SiO4 向混合液中加入过量NaOH,过滤,向滤液中通入足量CO2,再过滤 3.5×10-2mol/L
2NaGaO2+CO2↑ H2SiO3或H4SiO4 向混合液中加入过量NaOH,过滤,向滤液中通入足量CO2,再过滤 3.5×10-2mol/L ![]() 抑制
抑制![]() 水解,并阻止H+在阴极放电降低电解效率
水解,并阻止H+在阴极放电降低电解效率
【解析】
混合焙烧时,Al2O3、Ga2O3、SiO2与Na2CO3反应,生成可溶性盐NaAlO2、NaGaO2、Na2SiO3,CaO、MgO、Fe2O3不发生反应;将固体溶解,MgO、Fe2O3不溶于水,CaO溶于水生成Ca(OH)2,溶液中溶质为Ca(OH)2、NaAlO2、NaGaO2、Na2SiO3、Na2CO3;加入盐酸后,溶液中溶质为FeCl3、MgCl2、CaCl2、AlCl3、GaCl3、NaCl,生成的硅酸不溶,滤渣为H2SiO3或H4SiO4,然后将滤液进行树脂吸附,得到含铝混合液和洗脱液,然后将洗脱液中的Fe3+除去,最终通过电解![]() 制备Ga。
制备Ga。
(1)将粉煤灰与纯碱粉末充分混合,可以增大反应物接触面积,加快化学反应速率;SiO2与Na2CO3固体在加热条件下能够生成Na2SiO3、CO2,因此Ga2O3在此过程中发生反应的化学方程式为:Ga2O3+Na2CO3![]() 2NaGaO2+CO2↑;
2NaGaO2+CO2↑;
(2)由上述分析可知,滤渣为:H2SiO3或H4SiO4;Al(OH)3为两性氢氧化物,能溶于强碱溶液,而Fe(OH)3、Mg(OH)2不溶于强碱溶液,因此可将Al元素转化为偏铝酸盐,然后通入CO2制取纯净的Al(OH)3,实验方案为:向混合液中加入过量NaOH,过滤,向滤液中通入足量CO2,再过滤;
(3)当c(Fe3+)恰好为l×l0-5mol·L-l时,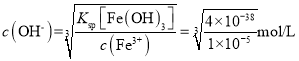 ,若此时Ga3+恰好开始沉淀,则
,若此时Ga3+恰好开始沉淀,则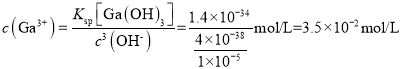 ;
;
(4)电解过程中,![]() 中Ga元素从+3价降低至0价,发生还原反应生成Ga,阳极为水失去电子生成氧气,电解总反应为:
中Ga元素从+3价降低至0价,发生还原反应生成Ga,阳极为水失去电子生成氧气,电解总反应为:![]() ;
;![]() 属于弱酸阴离子,能够发生水解生成Ga(OH)3,会降低产率,若溶液酸度过高,则溶液中H+可能会发生还原反应生成H2,会降低阴极电解效率。
属于弱酸阴离子,能够发生水解生成Ga(OH)3,会降低产率,若溶液酸度过高,则溶液中H+可能会发生还原反应生成H2,会降低阴极电解效率。

 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案